阿那曲唑片,適用於絕經後婦女的晚期乳腺癌的治療。對雌激素受體陰性的病人,若其對他莫昔芬呈現陽性的臨床反應,可考慮使用本品。適用於絕經後婦女雌激素受體陽性的早期乳腺癌的輔助治療。
基本介紹
- 藥品名稱:阿那曲唑片
- 藥品類型:工傷醫保乙類雙跨
- 漢語拼音:A Na Qu Zuo Pian
- 用途分類:選擇性雌激素受體調節劑
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,
成份
化學名稱: 2,2'-[5-(1H-1,2,4-三吡咯-1-基-甲基)-1,3-亞苯基]雙(2-甲基丙腈)
其結構式為:
其結構式為:

分子式:C17H19N5
分子量:293.4
性狀
本品為白色薄膜衣片,除去包衣後顯白色。
適應症
適用於絕經後婦女的晚期乳腺癌的治療。對雌激素受體陰性的病人,若其對他莫昔芬呈現陽性的臨床反應,可考慮使用本品。
適用於絕經後婦女雌激素受體陽性的早期乳腺癌的輔助治療。
適用於絕經後婦女雌激素受體陽性的早期乳腺癌的輔助治療。
規格
1mg
用法用量
成人(包括老年人):口服,每日一次,每次1片。
兒童:本藥不推薦兒童服用。
腎功能損害:輕度至中度腎功能損害患者不用調整劑量。
肝功能損害:輕度肝功能損害患者不用調整劑量。
對於早期乳腺癌,推薦的療程為5年。
兒童:本藥不推薦兒童服用。
腎功能損害:輕度至中度腎功能損害患者不用調整劑量。
肝功能損害:輕度肝功能損害患者不用調整劑量。
對於早期乳腺癌,推薦的療程為5年。
不良反應
一般的不良反應

*陰道出血現象偶見報告,主要出現在晚期乳腺癌患者從原有的激素療法改為本品治療的前幾周。如有持續出血現象,應考慮做進一步的評估。
由於本片降低了循環中雌激素的水平,故有可能導致骨密度下降,使部分患者骨折的風險增加。
γ-GT和鹼性磷酸酶的升高偶見報告(≥0.1%,<1%)。但這些改變與藥物治療的因果關係尚未確定。
在ATAC試驗中出現的不良事件
用於安全性評估的輔助治療的中位期,阿那曲唑1mg組和他莫昔芬20mg組分別為59.8個月和59.6個月。
下表列出了在各治療組治療期間或治療結束後14天內出現的發生率至少為5%的不良事件。
在各治療組治療期間或治療結束後14天內出現的發生率至少為5%的不良事件

N = 接受治療的患者數 。
* 一名患者可能有多於一個的不良事件,包括在同一身體系統有多於一個的不良事件
+ 陰道出血未進行進一步診斷
下表列出了在ATAC試驗中,治療期間或治療結束後14天內患者報告的事先定義的不良事件(無論是否有因果關係)的發生率。
缺表
在68個月的中位隨訪期之後,阿那曲唑組和他莫昔芬組骨折發生率分別為22/1000患者年和15/1000患者年。阿那曲唑組觀察到的骨折率與相應年齡絕經人群中報告的範圍相似。尚無法確定,在ATAC試驗中阿那曲唑組患者觀察到的骨折和骨質疏鬆發生率是否反映了他莫昔芬具有保護作用,或阿那曲唑有特別的作用,或兩者皆是。
阿那曲唑組骨質疏鬆的發生率為10.5%,他莫昔芬組為7.3%。
禁忌
本品禁用於以下情況:
· 絕經前婦女;
· 懷孕或哺乳期婦女;
· 嚴重腎功能損害的病人(肌酐清除率小於20ml/min);
· 中到重度肝病患者;
· 已知對阿那曲唑或任何組份過敏的患者;
其它含有雌激素的療法可降低本品之藥理作用,所以禁止與本品伍用。
合併使用他莫昔芬治療(見“藥物相互作用”節)。
· 絕經前婦女;
· 懷孕或哺乳期婦女;
· 嚴重腎功能損害的病人(肌酐清除率小於20ml/min);
· 中到重度肝病患者;
· 已知對阿那曲唑或任何組份過敏的患者;
其它含有雌激素的療法可降低本品之藥理作用,所以禁止與本品伍用。
合併使用他莫昔芬治療(見“藥物相互作用”節)。
注意事項
尚未在兒童中確定本品的安全性和有效性,因此本品不推薦用於兒童。
對於激素狀態有懷疑的患者,應通過生化檢查的方法確定是否絕經(自然絕經或人工絕經)。
對中度到重度肝功能損害病人或重度腎功能損害的病人(肌酐清除率小於20ml/min),尚無支持本品安全套用的資料。
由於本品降低了循環中雌激素的水平,故有可能導致骨密度下降。目前上午充足的資料表明雙磷酸鹽對有阿那曲唑引起的骨密度下降的作用情況,或作為預防性使用的作用情況。
伴有骨質疏鬆或潛在的骨質疏鬆風險的婦女,應當在治療開始以及其後定期的進行正規的骨密度檢查,如DEXA掃描。應當在適當的時間開始骨質疏鬆的治療或預防,並進行仔細的監測。
在ATAC試驗中,與接受他莫昔芬治療的患者相比,有更多接受阿那曲唑治療的患者報告血清膽固醇升高(阿那曲唑治療組為9%和他莫昔芬治療組為3.5%)。
運動員慎用。
對駕駛和機械操作能力的影響
本品不太可能影響病人駕駛和機械操作能力,但曾有乏力和嗜睡的報告,在上述症狀持續出現於駕車和操作機械時,應特別注意。
對於激素狀態有懷疑的患者,應通過生化檢查的方法確定是否絕經(自然絕經或人工絕經)。
對中度到重度肝功能損害病人或重度腎功能損害的病人(肌酐清除率小於20ml/min),尚無支持本品安全套用的資料。
由於本品降低了循環中雌激素的水平,故有可能導致骨密度下降。目前上午充足的資料表明雙磷酸鹽對有阿那曲唑引起的骨密度下降的作用情況,或作為預防性使用的作用情況。
伴有骨質疏鬆或潛在的骨質疏鬆風險的婦女,應當在治療開始以及其後定期的進行正規的骨密度檢查,如DEXA掃描。應當在適當的時間開始骨質疏鬆的治療或預防,並進行仔細的監測。
在ATAC試驗中,與接受他莫昔芬治療的患者相比,有更多接受阿那曲唑治療的患者報告血清膽固醇升高(阿那曲唑治療組為9%和他莫昔芬治療組為3.5%)。
運動員慎用。
對駕駛和機械操作能力的影響
本品不太可能影響病人駕駛和機械操作能力,但曾有乏力和嗜睡的報告,在上述症狀持續出現於駕車和操作機械時,應特別注意。
孕婦及哺乳期婦女用藥
本品禁用於孕婦或哺乳期婦女。
兒童用藥
尚未在兒童中確定本品的安全性和有效性,因此本品不推薦用於兒童。
老年用藥
參見【用法用量】。
藥物相互作用
安替比林和西咪替丁藥物臨床相互作用的研究表明:本品同其他藥物合用時不易引起由細胞色素P-450所介導的藥物相互作用。
對臨床試驗安全性數據進行回顧,未發現本品同其他臨床常用藥物之間有明顯的相互作用。
含有雌激素的療法可降低本品之藥理作用,故不宜同本品合用。
他莫昔芬可能降低本品的藥理作用,故不應同本品合用。
對臨床試驗安全性數據進行回顧,未發現本品同其他臨床常用藥物之間有明顯的相互作用。
含有雌激素的療法可降低本品之藥理作用,故不宜同本品合用。
他莫昔芬可能降低本品的藥理作用,故不應同本品合用。
藥物過量
目前在意外藥物過量方面的經驗有限。動物試驗證明阿那曲唑的急性毒性很低。臨床研究中也進行了不同劑量的研究:在健康男性志願者中最大單一劑量達60mg,絕經後晚期乳腺癌婦女每日達10mg 時仍然可被良好耐受。未得到產生有危及生命症狀的單一劑量。本品藥物過量無專門解救藥,治療只能對症處理。
在處理藥物過量時應考慮到同時套用了多種藥物的可能性。
若病人清醒則可以進行催吐。因本品蛋白結合率較低,故透析可以奏效。應給予一般的支持性監護包括密切觀察病人並監測其生命體徵。
在處理藥物過量時應考慮到同時套用了多種藥物的可能性。
若病人清醒則可以進行催吐。因本品蛋白結合率較低,故透析可以奏效。應給予一般的支持性監護包括密切觀察病人並監測其生命體徵。
臨床試驗
在一項大型的III期臨床研究(ATAC)中,對9366名可進行手術治療的絕經後乳腺癌婦女進行5年治療的研究,結果顯示阿那曲唑與他莫昔芬相比,在無病生存上具有統計學意義的優勢 ;對激素受體陽性的患者群進行前瞻性分析發現,阿那曲唑與他莫昔芬相比,在無病生存上觀察到了更大幅度的受益 ;在至復發時間上,阿那曲唑與他莫昔芬相比,具有統計學意義的優勢,兩者差值幅度在意向治療人群(ITT)和激素受體陽性人群中要比無病生存的差值更大 ;在至遠處復發時間上,阿那曲唑與他莫昔芬相比,具有統計學意義的優勢 ;阿那曲唑與他莫昔芬相比,對側乳腺癌發生率有統計學意義的降低 ;經過5年的治療,阿那曲唑在總體生存上至少與他莫昔芬同樣有效。然而,由於死亡率較低,仍需進一步隨訪以準確確定阿那曲唑相對於他莫昔芬的長期生存情況。對於ATAC 研究中經過5年治療的患者來講,68個月的中位隨訪時間還不足以比較阿那曲唑相對於他莫昔芬治療後的長期效果(見下表)。
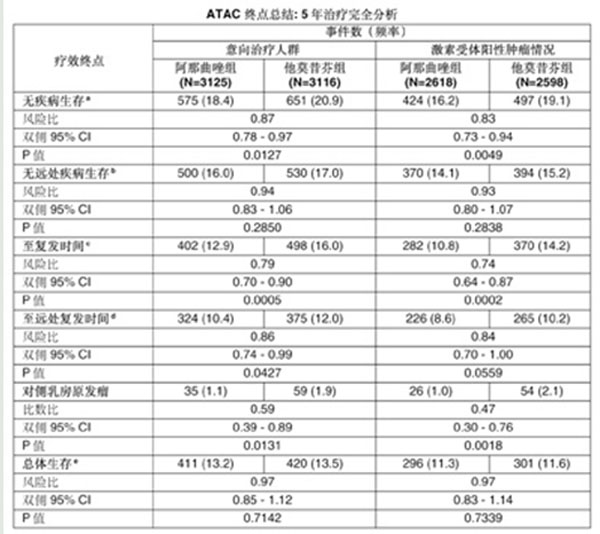
a 無疾病生存,疾病包括所有復發事件,定義為首次出現局部區域性復發,對側新髮乳腺癌,遠處復發或死亡(任何原因引起的)
b 無遠處疾病生存,遠處疾病定義為首次出現遠處復發或死亡(任何原因引起的)
c 至復發時間,復發定義為首次出現局部區域性復發,對側新髮乳腺癌,遠處復發或由乳腺癌造成的死亡
d 至遠處復發時間,遠處復發定義為首次出現遠處復發或由乳腺癌造成的死亡
e 死亡患者數(%)
藥理毒理
藥理作用:
ATC編碼:L02B G03(酶抑制劑)
本品為高效,高選擇性非甾體類芳香化酶抑制劑。絕經後婦女雌二醇的主要來源為:雄烯二酮在外周組織中的芳香化酶複合物的作用下轉化為雌酮,雌酮隨後轉化為雌二醇。減少循環中的雌二醇水平證明有利於乳腺癌婦女。高度靈敏的分析試驗顯示,絕經後婦女每日服用1mg 阿那曲唑可以降低 80%以上的雌二醇水平。
本品沒有孕激素樣、雄激素樣及雌激素樣活性。
在ACTH激發試驗之前或之後進行測定, 本品每日用量達10mg仍不影響皮質醇或醛固酮的分泌。因此服用本品時無需補充皮質激素。
如同所有治療決定一樣,乳腺癌婦女及其醫師應評估治療的相對獲益和風險。
當本品與他莫昔芬聯合使用時,無論激素受體狀態如何,其療效和安全性與單獨使用他莫昔芬相似。其確切的機制尚不清楚,但不認為是本品降低了抑制雌二醇的程度所引起的。
毒理研究:
急性毒性
在對嚙齒類動物進行的急性毒性試驗中,阿那曲唑的半數致死量為口服大於100mg/kg/天、腹腔注射大於50mg/kg/天。狗的半數致死量為口服阿那曲唑大於45mg/kg/天。
長期毒性
使用大鼠和狗進行多次給藥毒性試驗,未建立阿那曲唑無作用劑量水平,在小劑量組 (1mg/公斤/ 日)和中劑量組(狗3 mg/公斤/日,大鼠 5mg/公斤/日)下所觀察到的反應則同化合物本身的藥理作用或阿那曲唑酶誘導的特性相關,未有明顯毒性作用或變性改變。
致突變試驗
用阿那曲唑進行遺傳毒性研究證明其非誘變劑或分裂劑。
生殖毒性
妊娠大鼠和家兔口服給予阿那曲唑,最高分別達1.0和0.2mg/kg/天,未發現致畸作用,所觀察到的這些現象(大鼠胎盤增大,家兔流產)和該化合物的藥理學作用有關。
大鼠給予阿那曲唑0.02mg/kg/天或以上劑量時(從懷孕後17天至分娩後22天的大鼠)其子代的存活率下降,這些現象和該化合物對分娩的藥理學作用有關。對母代大鼠給予阿那曲唑治療未見對第一代子代行為或生殖機能有副作用。
致癌試驗
對大鼠進行為期2年的腫瘤形成研究結果表明,僅在高劑量阿那曲唑(25mg/kg/天)時雌性肝臟腫瘤和子宮基質息肉及雄性甲狀腺瘤的發生率有增加。引起此類改變的劑量是人用治療劑量的100倍,因此認為與阿那曲唑的治療沒有臨床相關性。對小鼠進行為期2年的腫瘤形成研究結果表明,可誘發良性卵巢腫瘤和淋巴網狀腫瘤發生率的紊亂(雌性組織細胞腫瘤減少和淋巴瘤引起的死亡增多)。此類改變被認為是芳香化酶抑制劑對小鼠的特殊作用,因此認為與阿那曲唑的治療沒有臨床相關性。
ATC編碼:L02B G03(酶抑制劑)
本品為高效,高選擇性非甾體類芳香化酶抑制劑。絕經後婦女雌二醇的主要來源為:雄烯二酮在外周組織中的芳香化酶複合物的作用下轉化為雌酮,雌酮隨後轉化為雌二醇。減少循環中的雌二醇水平證明有利於乳腺癌婦女。高度靈敏的分析試驗顯示,絕經後婦女每日服用1mg 阿那曲唑可以降低 80%以上的雌二醇水平。
本品沒有孕激素樣、雄激素樣及雌激素樣活性。
在ACTH激發試驗之前或之後進行測定, 本品每日用量達10mg仍不影響皮質醇或醛固酮的分泌。因此服用本品時無需補充皮質激素。
如同所有治療決定一樣,乳腺癌婦女及其醫師應評估治療的相對獲益和風險。
當本品與他莫昔芬聯合使用時,無論激素受體狀態如何,其療效和安全性與單獨使用他莫昔芬相似。其確切的機制尚不清楚,但不認為是本品降低了抑制雌二醇的程度所引起的。
毒理研究:
急性毒性
在對嚙齒類動物進行的急性毒性試驗中,阿那曲唑的半數致死量為口服大於100mg/kg/天、腹腔注射大於50mg/kg/天。狗的半數致死量為口服阿那曲唑大於45mg/kg/天。
長期毒性
使用大鼠和狗進行多次給藥毒性試驗,未建立阿那曲唑無作用劑量水平,在小劑量組 (1mg/公斤/ 日)和中劑量組(狗3 mg/公斤/日,大鼠 5mg/公斤/日)下所觀察到的反應則同化合物本身的藥理作用或阿那曲唑酶誘導的特性相關,未有明顯毒性作用或變性改變。
致突變試驗
用阿那曲唑進行遺傳毒性研究證明其非誘變劑或分裂劑。
生殖毒性
妊娠大鼠和家兔口服給予阿那曲唑,最高分別達1.0和0.2mg/kg/天,未發現致畸作用,所觀察到的這些現象(大鼠胎盤增大,家兔流產)和該化合物的藥理學作用有關。
大鼠給予阿那曲唑0.02mg/kg/天或以上劑量時(從懷孕後17天至分娩後22天的大鼠)其子代的存活率下降,這些現象和該化合物對分娩的藥理學作用有關。對母代大鼠給予阿那曲唑治療未見對第一代子代行為或生殖機能有副作用。
致癌試驗
對大鼠進行為期2年的腫瘤形成研究結果表明,僅在高劑量阿那曲唑(25mg/kg/天)時雌性肝臟腫瘤和子宮基質息肉及雄性甲狀腺瘤的發生率有增加。引起此類改變的劑量是人用治療劑量的100倍,因此認為與阿那曲唑的治療沒有臨床相關性。對小鼠進行為期2年的腫瘤形成研究結果表明,可誘發良性卵巢腫瘤和淋巴網狀腫瘤發生率的紊亂(雌性組織細胞腫瘤減少和淋巴瘤引起的死亡增多)。此類改變被認為是芳香化酶抑制劑對小鼠的特殊作用,因此認為與阿那曲唑的治療沒有臨床相關性。
藥代動力學
阿那曲唑的吸收較快,血漿最大濃度通常出現在服藥以後2 小時內(禁食條件下) 。
阿那曲唑清除較慢,血漿清除半衰期為 40- 50小時, 食物輕度影響吸收速度,但不影響 吸收程度。當每日一次頓服本品片劑時,食物對藥物吸收速度輕微的影響不致影響血漿穩態濃度。服用七天以後血漿濃度可達穩態濃度的90~95%,沒有證據表明阿那曲唑的藥代動力學參數是時間或劑量依賴性的。
絕經後婦女的年齡不影響本品的藥代動力學。
兒童中尚未進行該藥的藥代動力學研究。
阿那曲唑的血漿蛋白結合率僅為40%。
本品在絕經後婦女體內廣泛代謝,服藥後72小時內只有少於10%的劑量以原形從尿中排出。代謝過程包括N-去烷基、羥化和葡萄糖醛酸化。其代謝產物主要經尿排出,血漿中主要代謝產物三唑並不抑制芳香化酶活性。
穩定性肝硬化和腎功能損害的病人口服該藥的表觀清除率在健康志願者的觀測值範圍之內。
阿那曲唑清除較慢,血漿清除半衰期為 40- 50小時, 食物輕度影響吸收速度,但不影響 吸收程度。當每日一次頓服本品片劑時,食物對藥物吸收速度輕微的影響不致影響血漿穩態濃度。服用七天以後血漿濃度可達穩態濃度的90~95%,沒有證據表明阿那曲唑的藥代動力學參數是時間或劑量依賴性的。
絕經後婦女的年齡不影響本品的藥代動力學。
兒童中尚未進行該藥的藥代動力學研究。
阿那曲唑的血漿蛋白結合率僅為40%。
本品在絕經後婦女體內廣泛代謝,服藥後72小時內只有少於10%的劑量以原形從尿中排出。代謝過程包括N-去烷基、羥化和葡萄糖醛酸化。其代謝產物主要經尿排出,血漿中主要代謝產物三唑並不抑制芳香化酶活性。
穩定性肝硬化和腎功能損害的病人口服該藥的表觀清除率在健康志願者的觀測值範圍之內。
貯藏
不超過30℃保存。
包裝
PVC水泡眼,14片/板,1板/盒。
有效期
60個月。
執行標準
JX20070218
