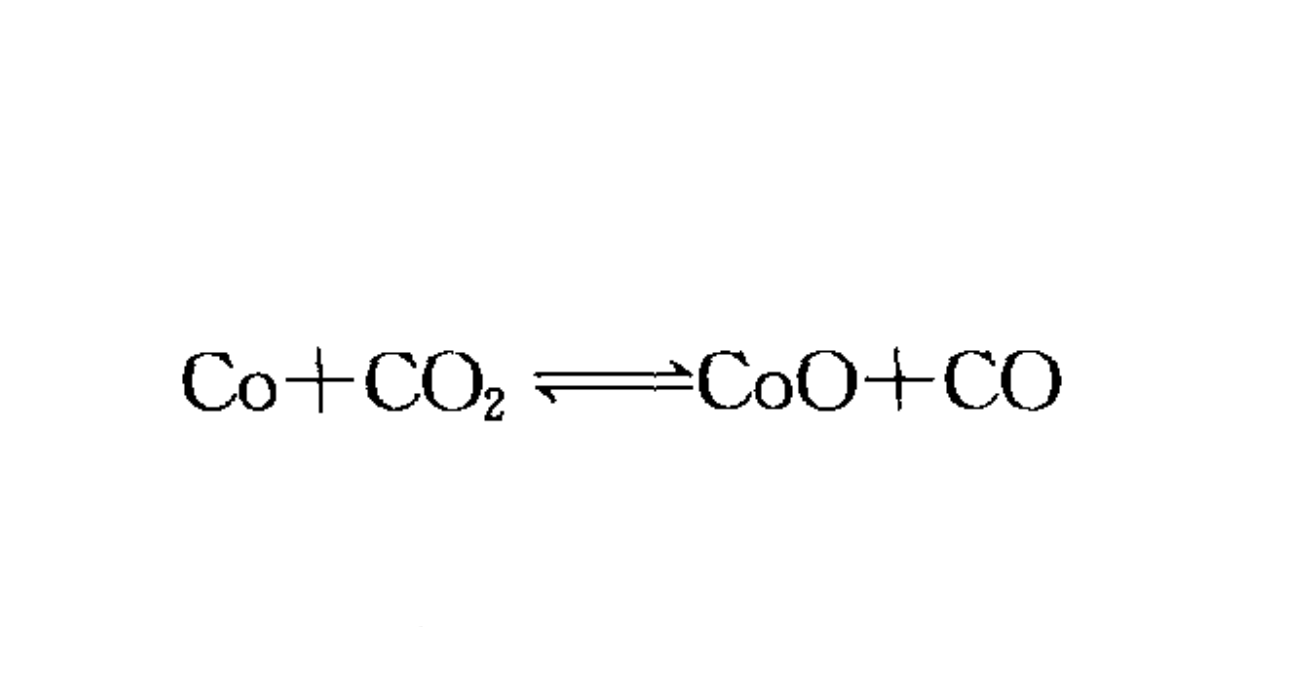研究簡史
鈷為英語cobalt的音譯,德文原型為Kobalt,源出希臘語cobalos,意為礦山。其德文辭彙系指一個善於惡作劇的幽靈(gnomes和goblins),在Saxony地方的德國礦工把這個術語套用於稱謂某些能傷害礦工手足的礦石,此術語便曾在歐洲廣為使用。這類礦物後來被發現是砷鈷礦。

鈷礦粉末
鈷的化學和冶金學大概是在16世紀中葉開始的,但早在前1450年的埃及人和巴比倫人製造的陶器中已經用到鈷顏料。鈷鹽可使陶瓷釉染上藍色,與鎳、鉻或錳化合物混配,可以調配出由藍至綠的所有色調。中國在元朝(13世紀)也已懂得用鈷土礦作顏料燒制釉下彩青花瓷器的技藝。
1735年,瑞典化學家Brandt發現了鈷元素。
1780年,瑞典化學家Bergman詳細研究了鈷元素的性質。
19世紀中葉,開始出現把鈷電鍍到金屬上的工作。
20世紀初,把鈷套用於制合金鋼和其它合金等方面的工作興起。
1917年,Honda宣布發現了含鈷的永磁合金。
1935年,永磁合金進一步得到發展,衍生出一系列鋁鎳鈷永磁材料(含Al,Ni,Fe,Co),後來又合成出新型的釤鈷永磁合金,鈷已成為一種重要的戰略金屬。
理化性質
物理性質
鈷的外貌和
純鐵或
鎳相似,硬度高於鐵,電解沉積出來的鈷其硬度又高於高溫生產的金屬鈷。鈷中含有少量碳時(最高達0.3%)會增大鈷金屬的抗張強度和耐壓強度,而不會影響其硬度。鈷可以機械加工,但略有脆性。鈷的物理性質不僅在極大程度上依賴於鈷的純度,而且也依賴於存在的異形變體(或異形變體混合物),關於鈷(即使其純度高於99.9%)已報導的物理性質常會有不一致的數據,這大概只能用鈷的兩種異構變體之間轉化速度很慢來加以解釋。
像鐵和鎳一樣,鈷是鐵磁性的,雖然鐵在鐵磁性元素中具有最高的磁化強度,而鈷卻是可以增大此磁化強度的唯一元素,純鐵的磁化強度為21500Gs,而組成為65%Fe、35%Co的合金其磁化強度卻可最高達到24·300Gs。鈷的更優越的磁性已知最高的居里點1121℃,已發展出多種多樣的特種專用的鈷鋼和鈷合金材料。

鈷的物理性質
化學性質
鈷的化合價為+2價和+3價。在常溫下不和水作用,在潮濕的空氣中也很穩定。在空氣中加熱至300℃以上時氧化生成CoO,在白熱時燃燒成Co
3O
4。
氫還原法製成的細金屬
鈷粉在空氣中能
自燃生成
氧化鈷。由電極電勢看出,鈷是中等活潑的金屬。其化學性質與
鐵,鎳相似。高溫下發生氧化作用。加熱時,鈷與
氧,硫,氯,溴等發生劇烈反應,生成相應化合物。鈷可溶於稀酸中,在發煙
硝酸中因生成一層氧化膜而被
鈍化。鈷會緩慢地被
氫氟酸,
氨水和氫氧化鈉浸蝕。鈷是
兩性金屬。
鈷即使在高溫下也很少吸
氫,氮在1200℃的高溫下也基本上不溶於鈷。微細分散的鈷粉在空氣中可自燃,但大塊的鈷金屬在低於300℃下,在空氣中仍是穩定的。將鈷加熱到900℃時在表面上生成的氧化物外殼第一層是Co
3O
4,靠近金屬的第二層是CoO;加熱至高於900℃時,Co
3O
4分解了,則氧化物外殼僅含有CoO。在加熱下鈷可與許多非金屬反應,例如可同鹵素、硼、硫、磷、砷和銻等反應,反應中往往發光發熱。氟與鈷反應可生成CoF
3,但其它鹵素僅能生成Co(Ⅱ)鹵化物。
鈷在燒至赤熱時會被水蒸氣氧化成CoO,在470℃時與氨反應生成Co
2N,但這個化合物在600℃時分解。
一氧化碳在200℃時和100atm下與微細鈷粉反應生成羰合物Co
2(CO)
8,但在溫度高於225℃和常壓下則生成碳化物Co
2C。
鈷比鐵較能耐抗無機酸的侵蝕,這可以從標準電極電勢數據看出:Co/Co+E°=一0.27V;Fe/Fe+E°=一0.44V。鈷能溶解在稀鹽酸和稀硫酸中並放出
氫氣。
濃硝酸在室溫下能快速地與鈷反應,但在-10℃時可使鈷表面鈍化。氫氟酸和磷酸也能與鈷作用,但鈷不與稀鹼溶液反應。
氯化氫在450℃時與鈷反應生成氯化鈷(Ⅱ);在400℃時將硫化氫通過於鈷粉之上可生成Co
3S
4,但在700℃時則生成CoS。二氧化碳在溫度高於700℃時與鈷發生如下平衡反應:
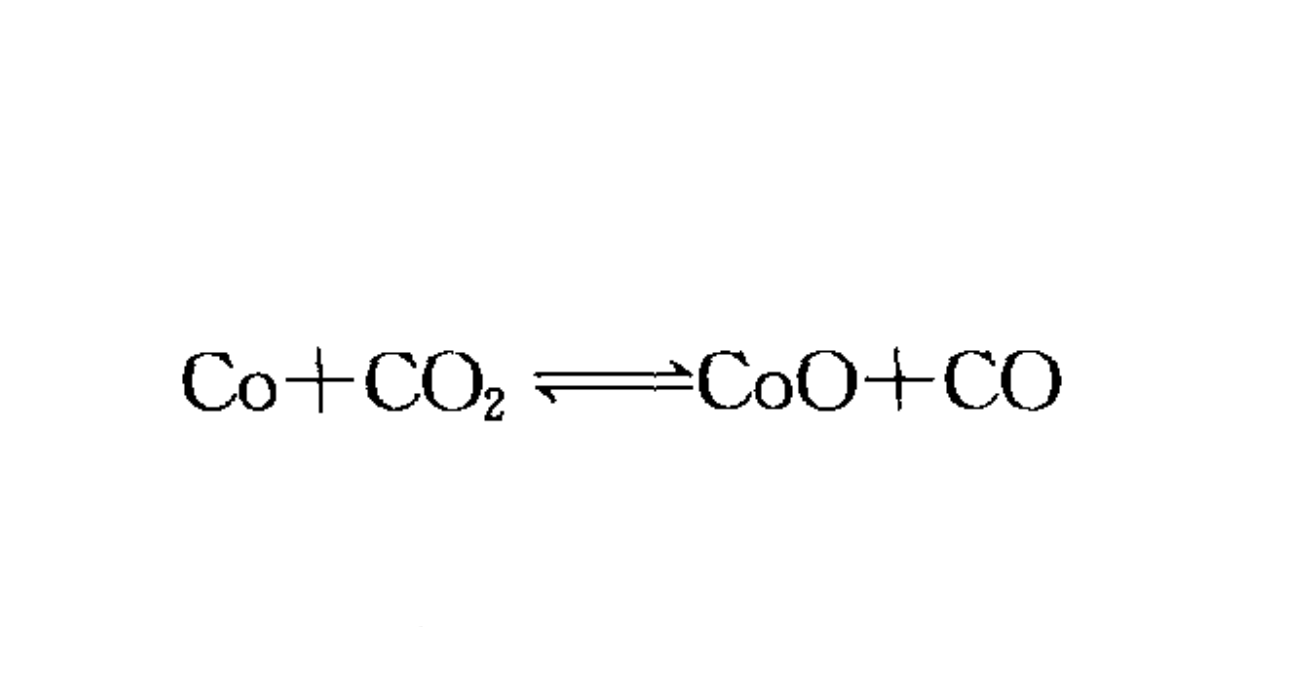
二氧化碳在溫度高於700℃時與鈷發生平衡反應
製備方法
鈷的製備一般先用火法將
鈷精礦、砷鈷精礦、含鈷硫化鎳精礦、銅鈷礦、鈷硫精礦中的鈷富集或轉化為可溶性狀態,然後再用濕法冶煉方法製成氯化鈷溶液或硫酸鈷溶液,再用
化學沉澱和
萃取等方法進一步使鈷富集和
提純,最後得到鈷化合物或
金屬鈷。
鈷礦物的賦存狀態複雜,礦石品位低,所以提取方法很多而且工藝複雜,
回收率較低。鈷礦的選礦對一般是將鈷礦石通過手選、重選、泡沫浮選可提取到含鈷15—25%的鈷精礦。鈷精礦冶煉方法主要有硫化鎳礦冶煉和砷鈷礦冶煉。
硫化鎳精礦一般含鎳4—5%,含鈷0.1—0.3%。鎳的火法熔煉過程中,由於鈷對氧和硫的親合力介於鐵鎳之間在轉爐吹煉
高冰鎳時,可控制冰鎳中鐵的氧化程度,使鈷富集於高冰鎳或富集於轉爐渣,分別用下述方法提取:
1、富集於高冰鎳中的鈷,在鎳電解精煉過程中,鈷和鎳一起進入陽極液。在淨液除鈷過程中,鈷以高價氫氧化鈷的形態進入鈷渣,鈷渣含鈷6—7%,含鎳25—30%。從此種鈷渣提鈷的一種方法是:將鈷渣加入硫酸溶液中,通二氧化硫使之溶解,製得含硫酸鎳、硫酸鈷和少量銅、鐵、砷、銻等雜質的溶液;再用活性鎳粉置換除去銅;通空氣,氧化水解除去鐵,通
氯氣氧化,加蘇打中和沉澱鈷,若所得氫氧化鈷含鎳較高,可再次溶解、沉澱分離鈷鎳,使其含鎳小於1%;經煅燒製得氧化鈷出售,也可將氧化鈷製成粗金屬鈷,經電解精煉得電解鈷。加拿大和蘇聯的鎳廠都用此法回收鈷。中國的工廠也有類似作法。從鈷渣提鈷的另一種方法是以
亞硫酸鈉作
還原劑,將鈷渣溶解於硫酸溶液中,得到含硫酸鎳、硫酸鈷和少量銅、鐵、錳、鋅等雜質的溶液,而後用黃鈉鐵礬法除去溶液中的鐵,用烷基磷酸類如:
二(2-乙基己基)磷酸(D-2-EHPA)或其他烷基磷酸酯類萃取劑萃取其中的銅、鐵、錳、鋅等,並分離鈷鎳。萃取過程中獲得的
氯化鈷溶液,用
氟化銨除鈣、鎂後,再用草酸銨沉澱鈷。所得草酸鈷在450℃下煅燒,得到的氧化鈷粉,可作為最終產品,也可用氫還原法製取金屬鈷粉。
2、富集於煉鎳轉爐渣中的鈷,在還原硫化熔煉過程中,與鎳一起轉入鈷冰銅。轉爐渣成分一般為:鈷0.25—0.35%,鎳1—1.5%;鈷冰銅成分一般為:鈷1—1.5%,鎳5—13%。鈷冰銅可以直接浸取(常壓或加壓酸浸),也可以將鈷冰銅焙燒成可溶性化合物後再酸浸。浸出液可按鈷渣提鈷工藝流程處理。
加拿大舍利特高爾頓公司(Sherritt Gordon MinesLtd)用高壓氨浸法處理硫化鎳精礦和高冰鎳時,鈷留於鎳的氫還原尾液中,通
硫化氫於尾液,得硫化鈷和硫化鎳的混合沉澱物。此混合物用硫酸高壓浸出、淨化除雜質後,通
氧、加
氨、加壓,使二價鈷氧化成可溶性的
,而鎳則以鎳銨硫酸鹽形態沉澱出來,實現鎳鈷分離,溶液用高壓氫還原產出鈷粉,也可用萃取法淨液、分離出鎳後電積得電鈷。含鈷黃鐵礦提鈷世界上從含鈷黃鐵礦中提鈷較有代表性的工廠是芬蘭科科拉鈷廠(Kok-kola Cobalt Plant),精礦焙燒脫硫後,再配以部分精礦在流態化爐內進行硫酸化焙燒,再經浸出、濃密、洗滌,浸出液通硫化氫使鈷呈硫化鈷沉澱。再利用上述舍利特高爾頓的高壓浸出法和高壓氫還原法生產鈷粉。
中國含鈷黃鐵礦的鈷品位較低,僅為0.02—0.09%。浮選產出的鈷硫精礦含鈷0.3—0.5%,硫30—35%,鐵35—40%。鈷硫精礦在流態化焙燒爐內於580—620℃下進行硫酸化焙燒,使鈷、鎳、銅等金屬轉化為可溶性的鹽類。焙砂用水或
稀硫酸浸出,用
氯酸鈉將浸出液中的鐵氧化成高價鐵後,用脂肪酸鈉依次萃取鐵和銅。然後,通入氯氣使鈷氧化,加鹼水解生成高價氫氧化鈷沉澱,而與鎳分離。在
反射爐內使氫氧化鈷脫水、燒結,燒結塊配以
石油焦和石灰石在三相電弧爐內還原熔煉成粗金屬鈷。粗鈷澆鑄成陽極,進行隔膜電解,得到純度較高的金屬鈷。鈷硫精礦也可先經900—950℃氧化焙燒,再配以
氯化鈉或
氯化鈣以及少量的鈷硫精礦於680℃下進行硫酸化氯化焙燒。焙砂按上述流程提鈷。
砷鈷礦經選礦得到含鈷10—20%的精礦,其中含砷20—50%。處理砷鈷礦的方法主要有兩種,一種是先用火法熔煉產出砷冰鈷,再用濕法提鈷。另一種是用加壓浸出法製得含鈷溶液,再從中提取鈷。中國採用前者:將精礦配以焦炭和熔劑在反射爐或電爐內熔煉,使部分砷呈
三氧化二砷揮發,產出砷冰鈷(舊稱
黃渣)。如原料含硫高,還產出部分鈷冰銅。砷冰鈷和鈷冰銅磨細後焙燒,進一步脫砷和硫;焙砂用稀硫酸浸出,用
次氯酸鈉氧化浸出液中的鐵,再用蘇打調整pH為3—3.5,使鐵成為
氧化鐵和
砷酸鐵沉澱。濾液用鐵屑置換除銅後,用次氯酸鈉使鈷氧化,加鹼水解生成高價氫氧化鈷沉澱而與鎳分離。所得氫氧化鈷在反射爐內於1000~1200℃下煅燒,獲得氧化鈷,並使其中的鹼式硫酸鹽分解,將硫除去。然後配入木炭,在迴轉窯內於1000℃左右還原成金屬鈷粉。也可將氫氧化鈷熔煉成粗金屬鈷,再進行電解得電鈷。焙砂的浸出液也可和前述硫化鎳礦提鈷一樣,採用萃取法淨液分離提鈷。
加壓酸浸法處理砷鈷精礦是將精礦用稀硫酸漿化,用高壓釜浸出,操作壓力35公斤力/厘米,溫度190℃,浸出時間3~4小時,鈷的浸出率95—97%。浸出液除砷、鐵、銅、鈣等雜質後,加入液氨,使鈷形成鈷氨絡合物,在高壓釜內,用氫還原得到鈷粉,操作壓力50—55公斤力/厘米,溫度190℃。此法流程簡單,回收率高,勞動條件好。銅鈷礦提鈷薩伊的盧伊盧廠(Luilu CobaltPlant)是世界上處理銅鈷礦最大的鈷廠。銅鈷礦經選礦獲得氧化精礦和硫化精礦。氧化精礦品位為:銅25%,鈷1.5%;硫化精礦品位為:銅45%,鈷2.5%。首先將硫化精礦在流態化焙燒爐內進行硫酸化焙燒,然後將焙砂和氧化精礦一起用銅電解廢液浸出。氧化精礦中的鈷主要呈三價氧化物形態,在硫酸中溶解度很小,但在銅電解廢液中可由其中的
亞鐵離子將鈷還原,溶於電解廢液中,Co
3(不溶性)Fe
2→Co
2(可溶性)Fe
3。鈷的浸出率可達95—96%。含鈷和銅的浸出液用
電解法析出銅,而鈷和其他金屬雜質留在溶液中。除雜質後,將溶液中的鈷用石灰乳沉澱為氫氧化鈷,再溶於硫酸中,得到高濃度的
硫酸鈷溶液,最後用不溶陽極電積金屬鈷。
套用領域
工業用途
製造電池設備是鈷最重要的用途,使用量占到全部鈷使用量的40%。鈷主要用來製作鋰離子電池的鈷酸鋰,鎳氫電池的氧化亞鈷等。含鈷材料是穩定的鋰電池正極材料,是電池的核心之一,具有能量密度高和環保全全性高的特點。
三元鋰電池是指使用鎳鈷錳或者鎳鈷鋁酸鹽等三元材料為電池正極的鋰電池。相對於傳統鋰電池,三元鋰電池具有綜合性能和低成本的雙重優勢。
鈷常被添加到鋼或者其他合金當中,可以明顯提高合金的堅硬程度、耐磨程度、抗衝擊性能和韌性。該合金常常被熔焊到其他材料的表面,能夠明顯延長零件的使用壽命。大約有20%的鈷被用來製造這種超級合金。含鈷合金常被用來製造噴氣式飛機渦輪發動機的風扇扇葉,火箭和燃氣機輪等設備的耐熱部件等。生活中的含鈷鋼刀的耐磨性和切割性能也更加突出。

鈷磁性材料
鈷是一種被磁化之後就能長期保持磁性的金屬。鈷的這種優越磁性,使之被大量套用於製造高性能磁性材料。這種用途的鈷使用量大概占到總使用量的5%左右。高鈷含量的磁性鋼比一般磁性鋼的磁力密度更高,而且在高溫條件下這種磁性也不會輕易喪失。大型的永久磁體大多為含鈷合金,其中常用的是一種叫作阿爾尼克的合金材料,是由鈷、鎳、鋁製造的堅硬合金。
鈷被用作顏料的歷史在西方可以追溯到古埃及時期。在埃及法老
圖坦卡蒙的墓穴中有一小塊玻璃器物,後來檢測其深藍色是因為存在鈷的緣故。古希臘人和古羅馬人曾利用鈷化合物製造有色玻璃,這種玻璃會表現出美麗的深藍色。而在中國,鈷及其化合物也有悠久的顏料使用史。唐朝著名的唐三彩,元代的青花瓷,明代的景泰藍無不與含鈷的釉料有關,而這種鈷顏料製造出的藍色不僅著色率強、發色鮮艷而且呈色穩定、歷久彌新。
鈷藍化學成分為鋁酸鈷,是鋁和氧化鈷反應生成的一種顏料,表現為藍色或藍綠色調,被大量作為陶瓷、琺瑯、玻璃等許多材料的著色劑使用。日常生活中見到的食品用矽膠乾燥劑中就加入了氧化鈷,無水時表現為藍色,在吸取空氣中的水後變為粉紅色。
鈷紫顏料也常被用於陶瓷、玻璃等的顏料,其成分為磷酸鈷,為一種特殊的紫色顏料。鈷黑顏料有鐵鈷黑和鐵鈷鉻黑兩種,主要用於陶瓷坯體和釉料的著色,是由多種金屬氧化物經過高溫固相反應而生成的高性能無機顏料,具有環保無毒的優點。
醫療用途
鈷在醫療領域也有多方面的套用,鈷-60放射性同位素被用來治療人體的皮膚病和惡性腫瘤;維生素B12(鈷胺素)中鈷的含量更是高達4.5%;鈷被用於製造人工髖關節和膝關節以及牙料填充劑。具有放射性的鈷同位素還被廣泛套用於輻照食品加工行業,通過這種輻照技術可以殺死有害的細菌。
分布情況
鈷在地殼中的平均含量為0.001%(質量),海洋中鈷總量約23億噸,自然界已知含鈷礦物近百種,但沒有單獨的鈷礦物,大多伴生於鎳、銅、鐵、鉛、鋅、銀、錳、等硫化物礦床中,且含鈷量較低。全世界已探明鈷金屬儲量148萬噸,中國已探明鈷金屬儲量僅47萬噸。分布於全國24個省(區),其中主要有甘肅、青海、山東、雲南、湖北、青海、河北和山西。這七個省的合計儲量占全國總保有儲量的71%,其中以甘肅儲量最多,占全國的28%。此外,安徽、四川、新疆等省(區)也有一定的儲量。世界鈷產量1986年達到頂峰3萬噸,以後不斷下降,到1989年只有2.5萬噸左右。薩伊和尚比亞是最大的鈷生產國,其產量約占世界總產量的70%。

鈷礦
自然界中已發現的鈷礦物和含鈷礦物共百餘種,分屬於單質、
碳化物、
氮化物、
磷化物和矽磷化物、砷化物和硫砷化物、銻化物和硫銻化物、
碲化物和硒碲化物、
硫化物、
硒化物、
氧化物、
氫氧化物和含水氧化物氫氧化物、砷酸鹽、碳酸鹽以及
矽酸鹽等14大類。其中以硫化物、砷化物和硫砷化物最多,主要的鈷礦物為:硫鈷礦(Co
3S
4)、纖維柱石(CuCo
2S
4)、
輝砷鈷礦(CoAsS)、砷鈷礦(CoAs
2)、
鈷華(3CoO·As
2O
5·8H
2O)等。
2004年,世界鈷開採量為5.24萬噸,其中,剛果開採1.6萬噸,尚比亞1萬噸,澳大利亞6700噸,加拿大5200噸,俄羅斯4700噸。中國已探明的鈷儲量最大的是甘肅金川硫化鎳礦中伴生的鈷。雲南的
矽酸鎳礦以及四川、山東、湖北、山西、廣東等地的黃鐵礦中也含有鈷。中國鈷金屬資源量約為140萬噸,絕大多數為伴生資源,單獨的鈷礦床極少。中國鈷礦品位較低,均作為礦山副產品回收,生產過程中由於品位低、生產工藝複雜,因此金屬回收率低、生產成本高。1996年中國鈷金屬產量(鈷含量)229噸,鈷硫精礦產量(鈷含量)192噸,氧化鈷638噸。2005年前後中國鈷的年消費量穩定在1200噸左右,國內鈷產量包括氧化鈷折算為鈷每年總計約600—700噸,國內鈷產量尚不能滿足國內需求,每年約有半數需進口。
安全措施
健康危害
鈷塵可引起“硬質合金病”("硬金屬病"),表現為過敏性哮喘,呼吸困難、乾咳、偶有化學性肺炎(間質性肺炎),肺水腫。脫離接觸後症狀緩解。CoO也可引起哮喘。
鈷對皮膚的影響主要為過敏性或刺激性皮炎。外露皮膚出現紅斑,有輕微搔癢,常見於手、腕、前臂等部位和皮膚皺摺處,多於夏季發病,患者多為接觸鈷的新工人,在上述皮膚病患者中,皮試陽性可證明對鈷過敏。
吸入醋酸鈷粉塵可引起急性化學性胃炎症狀,有噁心、嘔吐、上腹部劇痛,後可有嘔血及便血。
危害防治
誤服鈷鹽,應洗胃;溶液濺入眼,用清水或生理鹽水沖洗至少15分鐘。
CaNa2-EDTA、CaDTPA、半胱氨酸可降低鈷毒性,可試用。皮炎可用乙酸和尿素霜軟膏塗抹局部。化學性肺炎和肺水腫患者應採用糖皮質激素治療。
毒理資料
經常注射鈷製劑或暴露於過量的原始鈷環境中,可引起鈷中毒。兒童對鈷的毒性敏感,應避免使用每千克體重超過1mg的劑量。在缺乏維生素B12和蛋白質以及攝入酒精時,毒性會增加,這在酗酒者中常見。有些鈷化合物可能會致癌。
生理作用
少量的鈷鹽對許多種類的生命體都是必須的,這其中也包括人類。
維生素B12的中心離子就是鈷,在土壤中缺乏鈷的地區,食草動物會發育不良。
鈷是中等活潑的金屬元素,有二價和三價二種化合價。鈷可經消化道和呼吸道進入人體,一般成年人體內含鈷量為1.1—1.5mg。在血漿中無機鈷附著在白蛋白上,它最初貯存於肝和腎,然後貯存於骨、脾、胰、小腸以及其它組織。體內鈷14%分布於骨骼,43%分布於肌肉組織,43%分布於其它軟組織中。
儲存運輸
應按照(GB13690-1992)易燃易爆危險品規定辦理,夏季應早晚運輸,防止陽光曝曬,搬運中不得過度撞擊、震盪、不得與固化劑同車運輸。儲存於密閉容器內,存放在陰涼、通風的庫房。應與氧化劑、酸類分開存放,切忌混儲。
相關法規
2017年10月27日,世界衛生組織國際癌症研究機構公布的致癌物清單初步整理參考,鈷和鈷化合物在2B類致癌物清單中。