鈰量法是以四價鈰離子溶液為標準溶液的氧化還原滴定方法。1861年由 L.T.蘭格建立。這種滴定方法具有許多的優點,套用在許多領域中。
基本介紹
- 中文名:鈰量法
- 外文名:cerium method
- 釋義:一種氧化還原滴定法
鈰量法的基本原理,鈰量法的終點指示劑,鈰量法的優缺點,鈰量法的套用,
鈰量法的基本原理
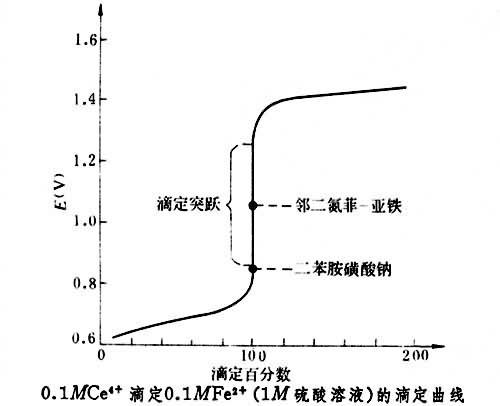
鈰量法即採用四價鈰鹽溶液作滴定劑的容量分析方法。1861年由 L.T.蘭格建立。在酸性溶液中,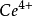 與還原劑作用,被還原為
與還原劑作用,被還原為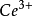 ,E°(
,E°(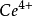 /
/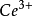 )=1.45伏。
)=1.45伏。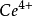 易水解而生成鹼式鹽沉澱,因此不適合在弱酸性或鹼性溶液中滴定。所以,常用硫酸鈰的硫酸溶液作滴定劑,它非常穩定,並且易純制,可用直接法配製標準溶液。
易水解而生成鹼式鹽沉澱,因此不適合在弱酸性或鹼性溶液中滴定。所以,常用硫酸鈰的硫酸溶液作滴定劑,它非常穩定,並且易純制,可用直接法配製標準溶液。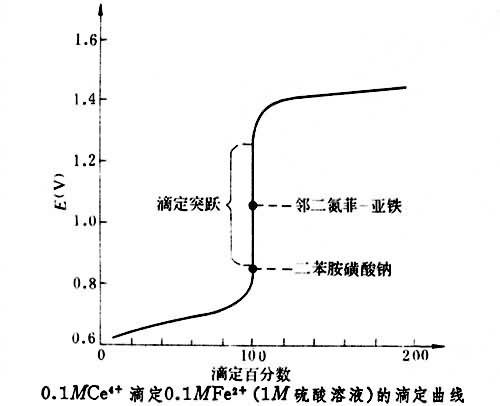
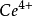
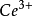
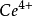
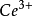
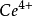

鈰量法的終點指示劑
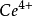
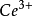
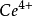
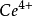
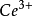
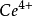
《中國藥典》採用鄰二氮菲作指示劑。鄰二氮菲指示液的配製是取硫酸亞鐵適量,加水溶解後,加硫酸和鄰二氮菲,搖勻,即得。鄰二氮菲和亞鐵離子的配合物為紅色,化學計量點後,指示劑中亞鐵離子被氧化成鐵離子,生成鄰二氮菲鐵,顯淡藍色而指示終點。用鄰二氮菲作指示劑,要求待測組分的還原性比指示劑強,這樣才能使待測組分被氧化完全後,指示劑才被氧化。
鈰量法的優缺點
① 硫酸鈰的標準溶液可以直接由 Ce(SO4)2(NH4)2SO4`H2O配製而不必標定配製的標準溶液且穩定性好,可長期放置。久置,曝光,甚至加熱煮沸均不引起濃度變化。
②選擇性高,可在鹽酸溶液里直接滴定一些還原劑,而氯離子不會干擾,大多數有機物不與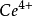 作用,不干擾滴定。
作用,不干擾滴定。
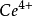
③反應機制簡單,副反應少,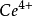 被還原為
被還原為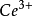 ,只有一個電子轉移,無中間價態的產物形成。
,只有一個電子轉移,無中間價態的產物形成。
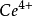
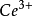
鈰量法的缺點是鈰鹽價格較貴。
鈰量法的套用
鈰量法由於不受製劑中澱粉、糖類的干擾,因此特別適合片劑、糖漿劑等製劑的測定。《中國藥典》2005年版採用鈰量法測定的藥物有:硫酸亞鐵片及硫酸亞鐵緩釋片、葡萄糖酸亞鐵及其製劑、富馬酸亞鐵及其製劑等。
另外,此方法可以直接測定一些金屬的低價化合物,過氧化氫及某些有機還原性物質。