《蝰蛇蛇毒血凝酶的層析純化方法》是合肥兆峰科大藥業有限公司於2002年12月05日申請的發明專利,該專利申請號為021538557,公布號為CN1504569,專利公布日為2004年06月16日,發明人是許貞玉、錢芳、夏紅梅、李兆羿。
注射用蛇毒血凝酶的純化工藝包括:蛇毒的溶解,親和層析分離得到類凝血酶和類凝血激酶的粗溶液,超濾濃縮,離子交換層析純化得到類凝血酶和類凝血激酶的純溶液,超濾濃縮,凝膠層析獲得類凝血酶和類凝血激酶的精純溶液,最後將上述類凝血酶和類凝血激酶的精純溶液按一定比例混合後,加入適量的賦形劑、穩定劑,經過濾、灌裝、冷凍乾燥、軋蓋,最終獲得注射用蛇毒血凝酶成品等工藝。本發明採用專一性吸附劑,可以一次性地快速完成大量酶溶液的粗提製備工作,並能最大程度地收集到粗品中的有效成分,且生物活性高。所得注射用蛇毒血凝酶經動物藥效學實驗,全血凝血時間明顯縮短,肝臟切口的失血量明顯減少,多種毒素測定結果均為陰性。
2021年8月16日,《蝰蛇蛇毒血凝酶的層析純化方法》獲得安徽省第八屆專利獎優秀獎。
基本介紹
- 中文名:蝰蛇蛇毒血凝酶的層析純化方法
- 公布號:CN1504569
- 公布日:2004年06月16日
- 申請號: 021538557
- 申請日:2002年12月05日
- 申請人:合肥兆峰科大藥業有限公司
- 地址:安徽省合肥市長江西路669號高新技術產業開發區
- 發明人:許貞玉、錢芳、夏紅梅、李兆羿
- Int.Cl.:C12N9/74、A61K38/48、A61P7/04
- 類別:發明專利
- 專利代理機構:北京集佳智慧財產權代理有限公司
- 代理人:王學強
專利背景,發明內容,專利目的,技術方案,改善效果,技術領域,權利要求,實施方式,榮譽表彰,
專利背景
立止血(Reptilase)又名巴特羅酶(Batroxobin),1936年由奧地利學者Klobusitzky第一個成功地從巴西矛頭蝮蛇(Bothopsatrox)的毒液中分離純化精製而得,是一種以止血作用為主的酶製劑,經數十年的臨床套用,證明了該藥具有顯著的止血功能。截至2002年12月,世界上生產該藥的國家有瑞士、法國、瑞典、日本等,他們所用的原料均從巴西進口,同時引進相應的酶純化技術。中國用的立止血(Reptilase)粉針是於1989年從瑞士Solco Basle Ltd公司進口的,僅此一項每年需花費幾百萬美元。Walter Kisiel,Mark A.Hermodson和Earl W.Davie等於1976年用凝膠(Sephadex G-150)過濾及強陰離子交換劑(QAE-Sephadex A-50)柱層析,從蝰蛇蛇毒(Russell’s Viper Venom)中分離純化得到類凝血激酶(Xa因子激活物),在未添加β巰基乙醇情況下採用7.5%的凝膠電泳,測得其全分子量約為90000道爾頓,採用10%的凝膠電泳,測得其全分子量為79000道爾頓;在添加β巰基乙醇情況下,採用7.5%的凝膠電泳,測得其重鏈分子量約為67000道爾頓,輕鏈分子量約為19000道爾頓,採用10%的凝膠電泳,測得其重鏈分子量約為59000道爾頓,輕鏈分子量約為20000和18000道爾頓,該產品一直未見上市。此工藝中採用的凝膠及強陰離子交換劑均為20世紀80年代的產品,由於其局限性(軟膠、流速慢、周期長、處理繁瑣、載樣量小),逐漸被新一代Bioprocess凝膠所替代。
發明內容
專利目的
《蝰蛇蛇毒血凝酶的層析純化方法》提供了一種新的使用層析法純化注射用蛇毒血凝酶的生產工藝,原料是廣東、廣西、福建等地產的蝰蛇蛇毒。該產品由兩種組份組成:一種是蝰蛇類凝血酶,一種是蝰蛇類凝血激酶,兩種酶按一定比例混合後所得到的混合液,每毫升含有一個克氏單位的血凝酶活性,同進口的立止血藥品成份一致,具有同等功效。經動物藥效學實驗證明,該產品具有縮短流血時間、減少失血量、加速止血的作用。
技術方案
《蝰蛇蛇毒血凝酶的層析純化方法》提供了一種具有高解析度、高載量、專一性吸附的層析純化方法,純化工藝如下:(1)將蝰蛇蛇毒用pH 7.0~9.0的0.01~0.1摩爾/升的tris-HCl緩衝液或磷酸鹽緩衝液溶解,離心去除沉澱。(2)用兩種不同配體的高解析度、高載量、專一性的吸附劑進行親和層析,再用pH 7.0~9.0的0.01~0.05摩爾/升的tris-HCl緩衝液和NaCl溶液線性梯度洗脫,純化得到類凝血酶和類凝血激酶的粗溶液。(3)超濾濃縮類凝血酶和類凝血激酶的粗溶液,置冰櫃中保存。(4)將所得類凝血酶和類凝血激酶的粗溶液分別經過陰離子交換柱層析,用pH 7.0~9.0的tris-HCl緩衝液和NaCl溶液線性梯度洗脫,純化得到類凝血酶和類凝血激酶的純溶液。(5)超濾濃縮類凝血酶和類凝血激酶的粗溶液,置冰櫃中保存。(6)將所得類凝血酶和類凝血激酶的純溶液分別經過凝膠過濾柱層析,用pH 7.0~9.0的tris-HCl緩衝液(含0.15摩爾/升的NaCl溶液)洗脫,得到類凝血酶和類凝血激酶的精純溶液。(7)將所得類凝血酶和類凝血激酶的精純溶液按一定比例混合後得到混合液,每毫升含有1個克氏單位的血凝酶活性,再加入適量的賦形劑、穩定劑進行過濾、灌裝、冷凍乾燥、軋蓋,即獲得注射用蛇毒血凝酶成品。在上述工藝中,類凝血酶的純化採用的親和層析吸附劑較佳地是苯甲脒(Benzamidine Sepharose 6B),所用緩衝液的濃度是0.01~0.05摩爾/升,NaCl溶液的梯度是0~0.6摩爾/升;類凝血激酶純化採用的親和層析吸附劑是肝素(Heparin Sepharose CL-6B),所用緩衝液的濃度是0.03~0.08摩爾/升,NaCl溶液的梯度是0.1~1.0摩爾/升。
改善效果
1)《蝰蛇蛇毒血凝酶的層析純化方法》由於採用高解析度、高載量、專一性吸附劑,所以在第一步粗分時,可以一次性快速地完成大量的酶溶液粗提製備工作,避免反覆上樣,為下一步層析節約了大量的時間。
2)該發明由於採用專一性吸附劑,所以能最大程度地收集到粗品中的有效成份,且生物活性高。
3)所得蛇毒血凝酶經動物藥效學實驗,0.1~0.2單位/千克的劑量即能使家兔全血凝血時間與用藥前相比縮短1/3~1/2,與陽性藥品立止血相比,效果相當。
4)所得蛇毒血凝酶經動物藥效學實驗,0.1~0.2單位/千克的劑量即能使家兔肝臟切口失血量與用藥前相比減少了53.84~58.33%,出血時間與用藥前相比縮短了43.5~51.5%,與陽性藥品立止血相比,效果相當。
5)所得蛇毒血凝酶經出血毒測定,100單位的劑量注射於小白鼠皮下,小白鼠無出血現象。
6)所得蛇毒血凝酶經其它幾種毒素測定,如磷脂酶A2、鹼性磷酸酶、L-胺基酸氧化酶等的活性測定均為陰性。由此證明,該產品完全可以替代進口立止血,且安全、高效、價格低廉。
7)該發明採用的親和層析吸附劑可反覆使用,不需作特殊處理,每次在上新樣品時,只需用上述緩衝液平衡即可。
技術領域
《蝰蛇蛇毒血凝酶的層析純化方法》涉及一種利用生化手段製備藥物的方法,尤其涉及到一種採用層析法分離純化一種具有止血功能的酶溶液——蛇毒血凝酶的生產工藝。
權利要求
1.《蝰蛇蛇毒血凝酶的層析純化方法》步驟包括:(1)將蝰蛇蛇毒用緩衝液溶解,離心去除沉澱;(2)用兩種不同配體的高解析度、高載量、專一性的吸附劑進行親和層析,再用pH 7.0~9.0的0.01~0.05摩爾/升的tris-HCl緩衝液和NaCl溶液線性梯度洗脫,純化得到類凝血酶和類凝血激酶的粗溶液;(3)濃縮類凝血酶和類凝血激酶的粗溶液,置冰櫃中保存;(4)將所得類凝血酶和類凝血激酶的粗溶液分別經過陰離子交換柱層析,用pH 7.0~9.0的tris-HCl緩衝液和NaCl溶液線性梯度洗脫,純化得到類凝血酶和類凝血激酶的純溶液;(5)濃縮類凝血酶和類凝血激酶的純溶液,置冰櫃中保存;(6)將所得類凝血酶和類凝血激酶的純溶液分別經過凝膠過濾柱層析,用pH 7.0~9.0的tris-HCl緩衝液洗脫,得到類凝血酶和類凝血激酶的精純溶液;(7)將所得類凝血酶和類凝血激酶的精純溶液按一定比例混合後得到混合液,每毫升含有1個克氏單位的血凝酶活性,再加入適量的賦形劑、穩定劑進行過濾、灌裝、冷凍乾燥、軋蓋,即獲得注射用蛇毒血凝酶成品。
2.根據權利要求1所述的蛇毒血凝酶的層析純化方法,其特徵在於步驟(1)所述的緩衝液是pH 7.0~9.0、濃度為0.01~0.1摩爾/升的tris-HCl緩衝液或者磷酸鹽緩衝液。
3.根據權利要求1所述的蛇毒血凝酶的層析純化方法,其特徵在於步驟(2)所述的親和層析工序中,純化類凝血酶採用的吸附劑是苯甲脒(Benzamidine Sepharose 6B),所用緩衝液的濃度是0.01~0.05摩爾/升,NaCl溶液的梯度是0~0.6摩爾/升;純化類凝血激酶採用的吸附劑是肝素(Heparin Sepharose CL-6B),所用緩衝液的濃度是0.03~0.08摩爾/升,NaCl溶液的梯度是0.1~1.0摩爾/升。
4.根據權利要求1所述的蛇毒血凝酶的層析純化方法,其特徵在於步驟(3)或者步驟(5)所採用的濃縮方法是超濾。
5.根據權利要求4所述的蛇毒血凝酶的層析純化方法,其特徵在於所述超濾使用的濾膜的截留分子量為1萬。
6.根據權利要求1所述的蛇毒血凝酶的層析純化方法,其特徵在於步驟(4)所述的陰離子交換柱層析採用的交換劑是DEAE-Sepharose Fast Flow。
7.根據權利要求1所述的蛇毒血凝酶的層析純化方法,其特徵在於步驟(4)所述的類凝血酶洗脫工序採用的是雙向梯度洗脫,即緩衝液pH梯度與NaCl線性梯度。
8.根據權利要求1所述的蛇毒血凝酶的層析純化方法,其特徵在於步驟(6)所述的tris-HCl緩衝液中含有濃度為0.15摩爾/升的NaCl。
實施方式
- 實施例1
類凝血酶工藝(1)粗毒的溶解:稱取蝰蛇毒5克,溶於30毫升濃度為0.02摩爾/升、pH8.0的tris-HCl緩衝液中,置4冰櫃內過夜,自然溶解,次日離心。離心轉速為4000rpm,離心時間為10分鐘,收集上清液待用。(2)裝柱:取直徑為5.0×30厘米的玻璃柱一根,用0.02摩爾/升、pH8.0的tris-HCl緩衝液平衡好的苯甲脒(Benzamidine Sepharose 6B)親和層析吸附劑裝柱,再用0.02摩爾/升、pH8.0的tris-HCl緩衝液洗脫平衡。(3)上樣、洗脫:取步驟(1)中粗毒溶解後所得的上清液上樣於步驟(2)中已平衡的柱內,進行線性梯度洗脫。洗脫液貯瓶內為8000毫升0.02摩爾/升、pH8.0的tris-HCl緩衝液(內含0.6摩爾/升的NaCl溶液),梯度瓶內為8000毫升0.02摩爾/升、pH8.0的tris-HCl緩衝液。起始為慢流速,每小時60毫升,在280納米波長處檢測吸收值。上樣5小時後,改為每小時300毫升,洗脫液用自動部分收集器收集,每小時收集12管,每管25毫升,洗脫曲線含6個蛋白峰,其中第6峰為類凝血酶活性峰,收集類凝血酶粗品溶液600毫升,含蛋白量350毫克。(4)超濾濃縮:將步驟(3)收集的類凝血酶粗品溶液用截留分子量為1萬的濾膜進行超濾,濃縮至體積為100毫升左右,置4℃冰櫃內保存。(5)DEAE-Sepharose Fast Flow陰離子交換柱層析:將步驟(4)濃縮的酶溶液上樣於已用0.02摩爾/升、pH8.2的tris-HCl緩衝液平衡好的陰離子交換柱內(柱子直徑為5.0×60厘米),進行雙向梯度洗脫。洗脫液貯瓶內為10000毫升0.02摩爾/升、pH6.0的tris-HCl緩衝液(內含0.5摩爾/升的NaCl溶液),梯度瓶內為10000毫升0.02摩爾/升、pH8.2的tris-HCl緩衝液。洗脫流速每小時為480毫升,在280納米波長處檢測吸收值。上樣5小時後,洗脫液用自動部分收集器收集,每小時收集20管,每管24毫升,經純化獲得類凝血酶純品溶液800毫升,含蛋白量180毫克。(6)超濾濃縮:將步驟(5)收集的類凝血酶純品溶液用截留分子量為1萬的濾膜進行超濾,濃縮至體積為50毫升左右,置4℃冰櫃內保存。(7)Sephacryl-100HR凝膠柱層析:將步驟(6)濃縮的酶溶液上樣於已用0.02摩爾/升、pH7.6的tris-HCl緩衝液(內含0.15摩爾/升 NaCl溶液)平衡好的凝膠柱內(柱子直徑為3.0×80厘米),進行層析。流速為每小時60毫升,經進一步純化,得精純的類凝血酶溶液120毫升,含蛋白量150毫克。(8)純度測定:取精純的類凝血酶溶液適量,經SDS-PAGE電泳,測得其分子量為36000±5000,純度為單一組份。1.2類凝血激酶工藝(1)粗毒的溶解:稱取蝰蛇毒5克,溶於0.05摩爾/升、pH9.0的tris-HCl的緩衝液30毫升中,置4℃冰櫃內過夜,自然溶解,次日離心。離心時轉速為4000rpm,離心時間為10分鐘,收集上清液待用。(2)裝柱:取直徑為5.0×30厘米的玻璃柱一根,用0.05摩爾/升、pH9.0的tris-HCl緩衝液平衡好的肝素(Heparin Sepharose CL-6B)親和層析吸附劑裝柱,再用0.05摩爾/升、pH9.0的tris-HCl緩衝液洗脫平衡。(3)Heparin Sepharose CL-6B親和層析:取步驟(1)中粗毒溶解後所得的上清液上樣於步驟(2)中已平衡好的親和層析柱內,進行線性梯度洗脫。洗脫液貯瓶內為8000毫升0.05摩爾/升、pH9.0的tris-HCl緩衝液(內含0.45摩爾/升的NaCl溶液);梯度瓶內為8000毫升0.05摩爾/升、pH9.0的tris-HCl緩衝液。起始流速為慢流速,每小時60毫升,在280納米波長處檢測吸收值。上樣5小時後,改為每小時300毫升。洗脫液用自動部分收集器收集,每小時收集12管,每管25毫升。洗脫曲線含7個蛋白峰,其中第3峰與第4峰之間的峰谷為活性組分。收集類凝血激酶粗品溶液550毫升,含蛋白量240毫克。(4)超濾濃縮:將步驟(3)的類凝血激酶粗品溶液用截留分子量為1萬的濾膜進行超濾,濃縮至體積為100毫升左右,置4℃冰櫃內保存。(5)DEAE-Sepharose Fast Flow陰離子交換柱層析:將步驟(4)濃縮的酶溶液上樣於已用0.05摩爾/升、pH8.4的tris-HCl的緩衝液平衡好的陰離子交換柱內(柱子直徑為5.0×60厘米),進行線性梯度洗脫。
洗脫液貯瓶內為10000毫升0.05摩爾/升、pH8.4的tris-HCl緩衝液(內含0.55摩爾/升的NaCl溶液),梯度瓶內為10000毫升0.05摩爾/升、pH8.4的tris-HCl緩衝液。流速為每小時480毫升,在280納米波長處檢測吸收值。上樣5小時後,洗脫液用自動部分收集器收集,每小時收集20管,每管24毫升。經純化獲得類凝血激酶純品溶液650毫升,含蛋白量為80毫克。(6)超濾濃縮:將步驟(5)的類凝血激酶純品溶液用截留分子量為1萬的濾膜進行超濾,濃縮至體積為50毫升左右,置4℃冰櫃內保存。(7)Sephacryl-300HR凝膠柱層析:將(6)濃縮的酶溶液上樣於已用0.02摩爾/升、pH7.6的tris-HCl緩衝液(內含0.15摩爾/升的NaCl溶液)平衡好的凝膠柱上進一步純化。柱子直徑為2.6×60厘米,流速為每小時0.5毫升,獲得精純類凝血激酶溶液80毫升,含蛋白量50毫克。1.3凝結活性的測定注射用蛇毒血凝酶含有兩種組份:類凝血酶和類凝血激酶。類凝血酶活性每毫克不得少於1500IU(國際單位)或1200BU凝血酶活性,類凝血激酶活性每毫克不得少於150IU(國際單位)或500KU。兩種酶按一定比例混合後所得的溶液,每毫升含有1個克氏單位的血凝酶活性,然後加入適量的賦形劑、穩定劑,進行過濾、灌裝、冷凍乾燥、軋蓋,即得注射用蛇毒血凝酶成品。1.4藥效學研究為了研究注射用蛇毒血凝酶對動物體內、外血液凝血和纖溶功能的影響,進行了動物藥效學試驗。研究單位是1986年被國家衛生部確定的新藥臨床研究基地—安徽醫科大學藥理教研室。研究結果表明,注射用蛇毒血凝酶可以明顯減少家兔肝臟切口失血量,縮短出血時間,並可明顯縮短全血凝血時間(CT),具體參數見表1: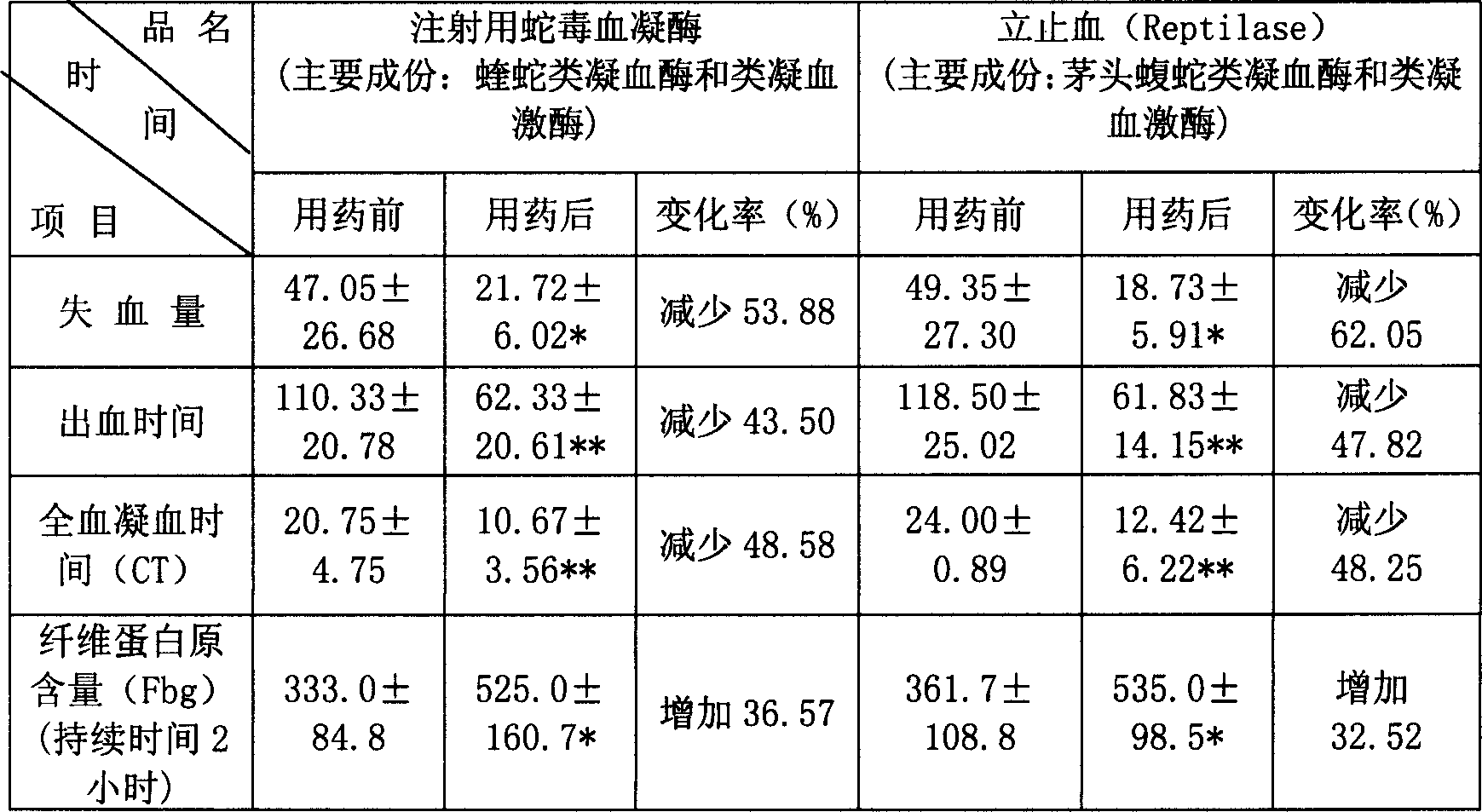

表1:同等劑量注射用蛇毒血凝酶與立止血(Reptilase)
(註:與用藥前相比,P<0.05 P<0.01)
- 實施例2
類凝血酶工藝除了在步驟(1)中是取蝰蛇毒5克,溶於0.01摩爾/升、pH8.5的磷酸鹽緩衝液中外,其它操作方法與實施例1相同,其中的親和層析吸附劑苯甲脒(Benzamidine Sepharose 6B)、陰離子交換劑(DEAE-SepharoseFast Flow)及凝膠(Sephacryl-100HR)均為實例1所用的,經用磷酸鹽緩衝液重新洗脫平衡,即可上樣。經分離純化得到類凝血酶溶液550毫升,含蛋白量275毫克。類凝血激酶工藝除了在步驟(1)中是取蝰蛇毒5克,溶於0.07摩爾/升、pH8.8的磷酸鹽緩衝液中外,其它操作方法與實施例1相同,其中親和層析吸附劑肝素(Heparin Sepharose CL-6B)、陰離子交換劑(DEAE-Sepharose Fast Flow)及凝膠(Sephacryl-300HR)均為實例1所用的,經用磷酸鹽緩衝液重新洗脫平衡,即可上樣。經分離純化得到類凝血激酶溶液520毫升,含蛋白量200毫克。凝結活性測定與動物藥效學實驗該批使用磷酸鹽緩衝液純化的酶溶液,經凝結活性測定及動物藥效學實驗均符合臨床用藥的質量標準。
榮譽表彰
2021年8月16日,《蝰蛇蛇毒血凝酶的層析純化方法》獲得安徽省第八屆專利獎優秀獎。

