英芬立適(吸附無細胞百日咳白喉破傷風聯合疫苗),適應症為
基本介紹
- 藥品名稱:英芬立適?
- 藥品類型:處方藥、基本藥物
- 用途分類:細菌類疫苗
成份與性狀,接種對象-預防用生物製劑,作用與用途-預防用生物製劑,規格,免疫程式和劑量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,藥物相互作用,藥理毒理,貯藏,包裝,有效期,執行標準,批准文號,生產企業,包裝企業,核准日期,
成份與性狀
本品由白喉類毒素、破傷風類毒素和3種純化的百日咳抗原[百日咳類毒素(PT)、絲狀血凝素(FHA)及69 KD外膜蛋白(百日咳桿菌粘附素)]按一定比例混合,經氫氧化鋁吸附而成。
白喉類毒素和破傷風類毒素是由白喉毒素和破傷風毒素經脫毒及純化製成。無細胞百日咳疫苗組份(PT、FHA和百日咳桿菌粘附素)製備於百日咳鮑特氏桿菌期培養物,經萃取、純化和甲醛處理。PT被不可逆轉地脫毒。
白喉類毒素、破傷風類毒素和無細胞百日咳疫苗成分吸附於氫氧化鋁。成品疫苗用生理鹽水配製,並用2-苯氧乙醇做為防腐劑。
該疫苗符合世界衛生組織關於生物製品生產以及白喉、破傷風疫苗的規程。在其生產過程中未使用人源性物質。
本品為白色混懸液。貯存後可見白色沉澱和上清液。
0.5毫升劑量疫苗包含不少於30國際單位(IU)的白喉類毒素、40 IU的破傷風類毒素、25μg的PT、25μg的FHA和8μg的百日咳桿菌粘附素。
白喉類毒素和破傷風類毒素是由白喉毒素和破傷風毒素經脫毒及純化製成。無細胞百日咳疫苗組份(PT、FHA和百日咳桿菌粘附素)製備於百日咳鮑特氏桿菌期培養物,經萃取、純化和甲醛處理。PT被不可逆轉地脫毒。
白喉類毒素、破傷風類毒素和無細胞百日咳疫苗成分吸附於氫氧化鋁。成品疫苗用生理鹽水配製,並用2-苯氧乙醇做為防腐劑。
該疫苗符合世界衛生組織關於生物製品生產以及白喉、破傷風疫苗的規程。在其生產過程中未使用人源性物質。
本品為白色混懸液。貯存後可見白色沉澱和上清液。
0.5毫升劑量疫苗包含不少於30國際單位(IU)的白喉類毒素、40 IU的破傷風類毒素、25μg的PT、25μg的FHA和8μg的百日咳桿菌粘附素。
接種對象-預防用生物製劑
吸附無細胞百日咳、白喉、破傷風聯合疫苗適用於2個月以上的個體。
作用與用途-預防用生物製劑
本品用於預防白喉、破傷風和百日咳疾病的初免;
還用於預防白喉、破傷風和百日咳的加強免疫。
還用於預防白喉、破傷風和百日咳的加強免疫。
規格
0.5ml/支
免疫程式和劑量
必須接種推薦的疫苗劑量(0.5毫升)。
由於各國的免疫程式不同,每個國家應按照本國的推薦程式進行。初免程式包括3劑接種,分別於第2年和6歲時進行加強接種。
吸附無細胞百日咳、白喉、破傷風聯合疫苗為深部肌肉注射。
由於各國的免疫程式不同,每個國家應按照本國的推薦程式進行。初免程式包括3劑接種,分別於第2年和6歲時進行加強接種。
吸附無細胞百日咳、白喉、破傷風聯合疫苗為深部肌肉注射。
不良反應
在臨床對照試驗中,每名接種者接種每一劑量疫苗後,主動監控並在日記卡上記錄其體徵和症狀。下表為接種者接種疫苗48小時內報告出現局部症狀的百分比的比較研究結果。
在相同的對比研究和相同的時間段內,全身反應情況總結如下:
由評價初免程式和加強劑量的其它研究可得到另外的安全數據。這些研究包括無對照研究,證實的DTPa安全性特徵總結如上。有加強免疫後紅腫超過10厘米的報告,這些均可自行消失。與其它疫苗一樣,如DT和DTP,偶然可見整個大腿部發生腫脹。
以下症狀有過報告:
●用本疫苗初免(共11406劑)
皮膚及附屬檔案(1%或更少):皮炎
呼吸系統(3%或更少):咳嗽、鼻是、支氣管史、其它上呼吸道感染
抵抗力(1%或更少):中耳炎
●用本疫苗初免並加強(共2363劑)
呼吸系統(4%或更少):咳嗽、咽炎,支氣管炎\其它上呼吸道感染、鼻炎、呼吸紊亂
抵抗力(3%或更少):病毒感染、中耳炎
●DTPw初免,用本疫苗加強(共606劑)
呼吸系統(3%或更少):咳嗽、咽炎、上呼吸道感染、支氣管炎
抵抗力(2%或更少):中耳炎
[u]非常罕見的過敏包括類過敏性反應有過報告。[/u]
極為罕見的接種2至3天后出現的虛脫和類休克狀態(低張力-低反應性情況)及驚厥亦有有報告。所有這些個體均完全自行恢復並沒有後遺症。
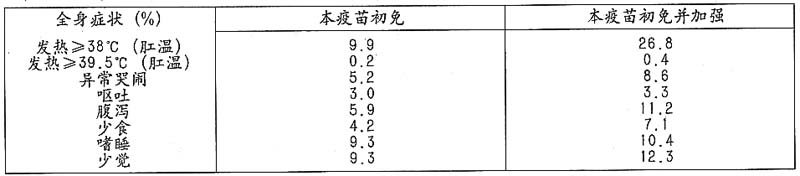
在相同的對比研究和相同的時間段內,全身反應情況總結如下:
由評價初免程式和加強劑量的其它研究可得到另外的安全數據。這些研究包括無對照研究,證實的DTPa安全性特徵總結如上。有加強免疫後紅腫超過10厘米的報告,這些均可自行消失。與其它疫苗一樣,如DT和DTP,偶然可見整個大腿部發生腫脹。
以下症狀有過報告:
●用本疫苗初免(共11406劑)
皮膚及附屬檔案(1%或更少):皮炎
呼吸系統(3%或更少):咳嗽、鼻是、支氣管史、其它上呼吸道感染
抵抗力(1%或更少):中耳炎
●用本疫苗初免並加強(共2363劑)
呼吸系統(4%或更少):咳嗽、咽炎,支氣管炎\其它上呼吸道感染、鼻炎、呼吸紊亂
抵抗力(3%或更少):病毒感染、中耳炎
●DTPw初免,用本疫苗加強(共606劑)
呼吸系統(3%或更少):咳嗽、咽炎、上呼吸道感染、支氣管炎
抵抗力(2%或更少):中耳炎
[u]非常罕見的過敏包括類過敏性反應有過報告。[/u]
極為罕見的接種2至3天后出現的虛脫和類休克狀態(低張力-低反應性情況)及驚厥亦有有報告。所有這些個體均完全自行恢復並沒有後遺症。


禁忌
對疫苗任何一種成份過敏者或以往注射吸附無細胞百日咳、白喉、破傷風聯合疫苗,白喉和破傷風疫苗或DTPw後出現過敏者禁用。
以前接種含百日咳成份疫苗7天內,出現不明原因腦病者禁用。這種情況下應繼續使用白喉、破傷風疫苗完成免疫程式。
以前接種含百日咳成份疫苗7天內,出現不明原因腦病者禁用。這種情況下應繼續使用白喉、破傷風疫苗完成免疫程式。
注意事項
免疫前詢問病史(尤其是既往接種史和可能發生的不良反應事件),並進行臨床檢查。
與其它疫苗一樣,對於患有嚴重急性發熱性疾病的個體應推遲接種本品。然而輕微感染不是禁忌症。
如以下任何情況發生,並認為與接種DTPa或DTPw有時間上的關聯時,後繼接種含百日咳成份的疫苗時要慎重考慮。可能會有某些情況,例如百日咳發病率高,當接種的潛在益處超過可能出現的危險時,特別是這些事件與永久性後遺症無關。
以下情況以前被認為是接種DTPw的禁忌症,現在被認為是一般注意事項:
●接種後48小時內體溫≥40.5℃,無其它可確認的原因。
●接種後48小時內出現虛脫或類休克狀態(低張力-低反應性症狀),
●接種後48小時內出現持久的、無法安慰的嚎哭持續時間≥3小時。
●接種後3天內出現伴有或不伴有發熱的驚厥。
高熱驚厥史和驚厥發作家族史者不是接種的禁忌。
HIV感染不是禁忌症。
與其它所有注射用疫苗一樣,為防止接種後可能出現的過敏反應,要準備適當的醫學處理。基於此原因,接種者注射後應進行醫學監護30分鐘。
對於所有白喉、破傷風和百日咳疫苗,每次接種應深部肌肉注射且最好輪流接種不同部位。
本疫苗用於有血小板減少症或有出血性疾病的個體時一定要注意,因為這些個體在肌注後可能產生出血。注射後應在注射部位緊壓至少兩分鐘(不要揉擦)。
吸附無細胞百日咳、白喉、破傷風聯合疫苗在任何情況下,都不能靜脈注射。
本疫苗使用前搖勻至白色均勻混懸液,並肉眼觀察是否有外來物和外觀的改變。如觀察到以上任何情況,應丟棄疫苗。
與其它疫苗一樣,對於患有嚴重急性發熱性疾病的個體應推遲接種本品。然而輕微感染不是禁忌症。
如以下任何情況發生,並認為與接種DTPa或DTPw有時間上的關聯時,後繼接種含百日咳成份的疫苗時要慎重考慮。可能會有某些情況,例如百日咳發病率高,當接種的潛在益處超過可能出現的危險時,特別是這些事件與永久性後遺症無關。
以下情況以前被認為是接種DTPw的禁忌症,現在被認為是一般注意事項:
●接種後48小時內體溫≥40.5℃,無其它可確認的原因。
●接種後48小時內出現虛脫或類休克狀態(低張力-低反應性症狀),
●接種後48小時內出現持久的、無法安慰的嚎哭持續時間≥3小時。
●接種後3天內出現伴有或不伴有發熱的驚厥。
高熱驚厥史和驚厥發作家族史者不是接種的禁忌。
HIV感染不是禁忌症。
與其它所有注射用疫苗一樣,為防止接種後可能出現的過敏反應,要準備適當的醫學處理。基於此原因,接種者注射後應進行醫學監護30分鐘。
對於所有白喉、破傷風和百日咳疫苗,每次接種應深部肌肉注射且最好輪流接種不同部位。
本疫苗用於有血小板減少症或有出血性疾病的個體時一定要注意,因為這些個體在肌注後可能產生出血。注射後應在注射部位緊壓至少兩分鐘(不要揉擦)。
吸附無細胞百日咳、白喉、破傷風聯合疫苗在任何情況下,都不能靜脈注射。
本疫苗使用前搖勻至白色均勻混懸液,並肉眼觀察是否有外來物和外觀的改變。如觀察到以上任何情況,應丟棄疫苗。
孕婦及哺乳期婦女用藥
由於吸附無細胞百日咳、白喉、破傷風聯合疫苗不用於成人,故沒有足夠的人類妊娠或哺乳期使用數據和動物繁殖研究數據。
藥物相互作用
吸附無細胞百日咳、白喉、破傷風聯合疫苗可在接種其它兒童疫苗前後任何時間接種或同時接種。
本疫苗可與b型流感嗜血桿菌(Hib)疫苗賀新立適[sup]®[/sup]或其它PRP-T Hib疫苗混於同一注射器使用。
接受免疫抑制劑治療的病人和免疫缺陷的病人可能不能產生足夠的免疫應答。
本疫苗不能與除賀新立適[sup]®[/sup]或其它PRP-T Hib疫苗以外的其它疫苗混於同一注射器中。
本疫苗可與b型流感嗜血桿菌(Hib)疫苗賀新立適[sup]®[/sup]或其它PRP-T Hib疫苗混於同一注射器使用。
接受免疫抑制劑治療的病人和免疫缺陷的病人可能不能產生足夠的免疫應答。
本疫苗不能與除賀新立適[sup]®[/sup]或其它PRP-T Hib疫苗以外的其它疫苗混於同一注射器中。
藥理毒理
[藥物特性]
疫苗的相關信息
吸附無細胞百日咳、白喉、破傷風聯合疫苗初免的免疫應答
在出生後6個月內使用3劑本疫苗初免程式後的1個月,超過99%的被接種嬰兒白喉和破傷風抗體滴度大於0.1 IU/毫升。
疫苗含有的PT、FHA和百日咳桿菌粘附素成份,被認為是抵抗百日咳的重要保護成份。在臨床研究中,對這些百日咳抗原產生免疫應答的超過95%。
用吸附無細胞百日咳、白喉、破傷風聯合疫苗加強免疫的免疫應答
在出生後第2年(13-24月齡),對用本疫苗初免的嬰兒用本疫苗進行加強免疫,所有嬰兒白喉和破傷風抗體滴度均大於0.1 IU/毫升。加強免疫後96%的兒童可檢測到對百日咳抗原的加強免疫應答。
吸附無細胞百日咳、白喉、破傷風聯合疫苗的保護效力
吸附無細胞百日咳、白喉,破傷風聯合疫苗預防WHO定義典型百日咳(有實驗室檢查證實的超過21天的發作性咳嗽)的保護效力通過以下研究被證實:
—— 在德國進行了一項前瞻性、盲法的家庭接觸研究(3、4、5月齡程式),根據從有典型百日咳指示病例的家庭第二次接觸收集的數據,顯示疫苗保護率為88.7%,對實驗室證實的,界定為14天及以上的任何種類咳嗽的輕型疾病保護率為73%,對7天及以上任何種類咳嗽的保護率是67%。
—— 在義大利進行的一項由國立健康研究所(NIH)資助的效力研究(2、4、6月齡程式)顯示疫苗的效力為84%。當按咳嗽類型及持續時間將百日咳的定義擴大為包括臨床輕型病例時,經計算本疫苗的效力為對超過7天的任何咳嗽為71%,超過14天的咳嗽為73%。
疫苗的相關信息
吸附無細胞百日咳、白喉、破傷風聯合疫苗初免的免疫應答
在出生後6個月內使用3劑本疫苗初免程式後的1個月,超過99%的被接種嬰兒白喉和破傷風抗體滴度大於0.1 IU/毫升。
疫苗含有的PT、FHA和百日咳桿菌粘附素成份,被認為是抵抗百日咳的重要保護成份。在臨床研究中,對這些百日咳抗原產生免疫應答的超過95%。
用吸附無細胞百日咳、白喉、破傷風聯合疫苗加強免疫的免疫應答
在出生後第2年(13-24月齡),對用本疫苗初免的嬰兒用本疫苗進行加強免疫,所有嬰兒白喉和破傷風抗體滴度均大於0.1 IU/毫升。加強免疫後96%的兒童可檢測到對百日咳抗原的加強免疫應答。
吸附無細胞百日咳、白喉、破傷風聯合疫苗的保護效力
吸附無細胞百日咳、白喉,破傷風聯合疫苗預防WHO定義典型百日咳(有實驗室檢查證實的超過21天的發作性咳嗽)的保護效力通過以下研究被證實:
—— 在德國進行了一項前瞻性、盲法的家庭接觸研究(3、4、5月齡程式),根據從有典型百日咳指示病例的家庭第二次接觸收集的數據,顯示疫苗保護率為88.7%,對實驗室證實的,界定為14天及以上的任何種類咳嗽的輕型疾病保護率為73%,對7天及以上任何種類咳嗽的保護率是67%。
—— 在義大利進行的一項由國立健康研究所(NIH)資助的效力研究(2、4、6月齡程式)顯示疫苗的效力為84%。當按咳嗽類型及持續時間將百日咳的定義擴大為包括臨床輕型病例時,經計算本疫苗的效力為對超過7天的任何咳嗽為71%,超過14天的咳嗽為73%。
貯藏
應貯藏於+2℃至+8℃。
嚴禁凍結。如發生凍結應丟棄。
嚴禁凍結。如發生凍結應丟棄。
包裝
1支/盒(預填充注射器和西林瓶)。
有效期
36個月。
疫苗的失效期標於標籤和包裝上。
疫苗的失效期標於標籤和包裝上。
執行標準
進口藥品註冊標準JS20010001。
批准文號
進口包裝文號:國藥準字J20050093
生產企業
葛蘭素史克生物製品公司
包裝企業
上海葛蘭素史克生物製品有限公司
核准日期
2007年01月19日
