天津大學物理化學教研室.物理化學:高等教育出版社,2009年5月第五版:564-566.
簡介,表示式,優點,
簡介
過渡態理論假設:
- 相互碰撞的反應物分子一旦獲得過渡態的構型就發生反應生成產物。
- 反應物與活化絡合物能按達成熱力學平衡的方式處理;
- 活化絡合物向產物的轉化是反應的決速步。
- 活化絡合物分子中沿反應坐標向產物轉化的運動可以與其它的運動分離。

根據統計熱力學平衡常數有關式子,可得:
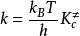

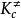
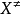
這就是由過渡狀態理論計算雙分子反應速率常數的基本方程,有時稱為艾林(Eyring H)方程
原則上只要知道了有關分子的結構就可以按上式計算速率常數k,而不必作動力學測定。
表示式
艾林方程熱力學表示式
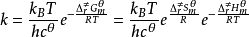
此即雙分子反應的艾林方程熱力學表示式。艾林方程亦可用於單分子或三分子反應,以及溶液反應,但形式與此式稍有差別。
優點
過渡態理論的優點
1. 形象地描繪了基元反應進展的過程,說明了反應途經的含義;
2. 原則上可以從原子結構的光譜數據和勢能面計算反應的速率常數k,故又稱絕對反應速率理論;
3. 對Arrhenius 的指前因子作了理論說明,認為它與反應的活化熵有關;
4. 形象地說明了反應為什麼需要活化能,以及反應遵循的能量最低原理。
:
過渡態理論的缺點
1. 引進的平衡假設和決速步假設並不能符合所有的實驗事實;
2. 對複雜的多原子反應,繪製勢能面有困難,使理論的套用受到一定的限制。
3. 對複雜的多原子反應,活化絡合物的構型還無法確定。
:

