《艾拉莫德結晶形態及其組合物》是天津藥物研究院於2005年10月9日申請的發明專利,該專利的申請號為2005100153402,公布號為CN1944420,公布日為2007年4月11日,發明人是梅林雨、梁忠信、王杏林、高晶,該專利屬自身免疫調節藥物技術領域。
《艾拉莫德結晶形態及其組合物》涉及N-[3-(甲醯胺基)-4-氧-6-苯氧基-4H-1-苯並吡喃-7-基]-甲烷磺醯胺的5種結晶形態(艾拉莫德)。另外該發明還涉及艾拉莫德結晶形態在治療風濕關節炎藥物方面的套用,含有艾拉莫德結晶形態的藥物組合物以及5種結晶形態艾拉莫德的製備方法。
2014年11月6日,《艾拉莫德結晶形態及其組合物》獲得第十六屆中國專利優秀獎。
基本介紹
- 中文名:艾拉莫德結晶形態及其組合物
- 公布號:CN1944420
- 公布日:2007年4月11日
- 申請號:2005100153402
- 申請日:2005年10月9日
- 申請人:天津藥物研究院
- 地址:天津市南開區鞍山西道308號
- 發明人:梅林雨、梁忠信、王杏林、高晶
- 分類號:C07D311/22(2006.01)、A61K31/352(2006.01)、A61P29/00(2006.01)、A61P19/02(2006.01)
- 代理機構:天津市傑盈專利代理有限公司
- 類別:發明專利
- 代理人:朱紅星
專利背景,發明內容,專利目的,技術方案,附圖說明,權利要求,實施方式,榮譽表彰,
專利背景
風濕關節炎(rheumatoid arthritis RA)是一種致殘性較強的系統性自身免疫性疾病,如不積極有效的治療,一般在1至2年內將發生關節侵蝕性病變。2005年10月前,RA治療為兩大類藥物,非甾體類抗炎鎮痛藥(NSAIDs)和改變病程抗風濕藥(DMARDs)。NSAIDs主要作用是減輕RA患者的關節疼痛、腫脹及改善關節功能,但並不改變疾病的進展,也不能防止關節的破壞,其對胃腸道的嚴重不良反應限制了它的使用。與NSAIDs相比,DMARDs的起效較慢、不良反應較多,且隨服藥時間延長,療效下降,但可阻止病程進展,防止關節破壞。為克服上述缺陷,天津藥物研究研發了抑制細胞因子(包括白介素-1,6,8)的產生、抑制淋巴細胞的增生抑制細胞因子(包括白介素-1,6,8)的產生和抑制淋巴細胞的增生的非甾體抗炎藥艾拉莫德(Iguratimod,T-614),研究結果表明,艾拉莫德對首次套用病情改善抗風濕藥(DMARDs)治療的患者和對此類藥物耐藥的患者來說均有效。
艾拉莫德的通用名為Iguratimod,化學名為N-[3-(甲醯胺基)-4-氧-6-苯氧基-4H-1-苯並吡喃-7-基]-甲烷磺醯胺,英文名稱為:N-[3-(formylamino)-4-oxo-6-phenoxy-4H-1-benzopyran-7-yl]-methanesulfonamide,其化學結構、製造方法、用途在日本特開2001-240540的特許公報已有收載,日本特開平2-49778號和日本再共表平6-623714號公開發表了艾拉莫德解熱鎮痛、抗關節炎作用,免疫調節作用,對自身免疫疾病的預防、治療作用。
艾拉莫德是一種治療關節炎的新型藥物,不僅能選擇性抑制COX-2,而且能調節T-細胞,具有自身免疫調節作用,比2005年10月前已有療法具有更好的療效和更少的副作用。Chem.Pharm.Bull.48<1>131-139.2000.和日本專利No97840敘述了艾拉莫德粉末製備。關於艾拉莫德結晶形態,截至2005年10月未見有關晶型的文獻報導。
發明內容
專利目的
《艾拉莫德結晶形態及其組合物》的目的在於提供一種或多種艾拉莫德晶型,用於治療關節炎。
該發明的另一個目的在於提供適合工業化生產的艾拉莫德晶型的製備法。
該發明的再一個目的在於提供含有艾拉莫德晶型的藥物組合物。
該發明還有一個目的是公開了含有艾拉莫德晶型的藥物組合物在製備治療風濕關節炎藥物方面的套用。
該發明人在實驗中意外的發現艾拉莫德具有多種結晶形態,與公開的艾拉莫德粉末相比,不同的晶體表現出優良的理化性質,溶媒回收經濟,含水量相對穩定並可直接用於藥物的製劑如膠囊和顆粒劑中從而改善了製劑的性能。該發明基於上述發現得以完成。
該發明所公開的的1-5種結晶形態具有良好的熔點和質量,其質量純度至少為99.5%。結晶形態的艾拉莫德晶型具有大規模合成或配製成治療用製劑所需的性能,對光、濕、熱穩定,便於生產、儲存。
技術方案
《艾拉莫德結晶形態及其組合物》所述的艾拉莫德新結晶形態,主要包括:乙醇溶劑化形(以下稱“形態1”),乙腈溶劑化形(以下稱“形態2”),二甲甲醯胺溶劑化形(以下稱“形態3”),丙酮溶劑化形(以下稱“形態4”),二氯甲烷溶劑化形(以下稱“形態5”)。
其中,艾拉莫德形態1,其使用Cu-Ka輻射,以度2θ表示的X射線粉末衍射光譜(“XRD”)在約光譜基本上在約26.00、約24.56、約20.80、約19.56、約17.54、約10.92和約6.88有一個或多個(以任何組合)峰;
結晶形態2的艾拉莫德其以度2θ表示的使用Cu-Ka輻射的X射線粉末衍射光譜(“XRD”)基本上在約24.48、約22.60、約21.76、約19.52、約10.84、約18.08、約17.56、約16.92、約11.20、約9.36、約8.64、約7.48、約6.84、約6.52和約5.60有一個或多個(以任何組合)峰;
結晶形態3的艾拉莫德其以度2θ表示的使用Cu-Ka輻射的X射線粉末衍射光譜(“XRD”)基本上在約27.28、約25.68、約25.24、約24.40、約24.04、約23.08、約20.16、約17.52、約10.56和約6.00有一個或多個(以任何組合)峰;
結晶形態4的艾拉莫德其以度2θ表示的使用Cu-Ka輻射的X射線粉末衍射光譜(“XRD”)基本上在約20.72、約19.52、約18.88、約17.56、約10.84、約9.04和約6.80有一個或多個(以任何組合)峰
結晶形態5的艾拉莫德其以度2θ表示的使用Cu-Ka輻射的X射線粉末衍射光譜(“XRD”)基本上在約28.00、約26.08、約25.64、約24.00、約23.6、約22.92、約22.56、約20.64、約20.00、約19.52、約18.32、約17.60、約16.36、約11.52、約9.32和約6.00有峰。
該發明所述1-5種結晶形態的艾拉莫德紅外吸收光譜在約3342、3276、3123、3065、2869、1687、1621、1531、1489、1425、1358、1264和1156厘米有特徵性譜帶,其DSC吸熱轉變在約236-240℃。
該發明提供的晶狀艾拉莫德1-5種形態,測試方法如下:
儀器 | 日本理學D/MAX-2500X射線多晶粉未衍射儀 |
靶 | Cu-Ka輻射(λ=1.5405),2θ=2-40℃ |
階躍角 | 0.04℃ |
計算時間 | 0.5秒 |
管壓 | 40千伏 |
管流 | 100毫安 |
掃描速度 | 8℃/分鐘 |
濾片 | 石墨單色器 |
儀器 | 日本理學標準型TG-DTA分析儀 |
溫度範圍 | 室溫~400℃ |
升溫速度 | 10℃/分鐘 |
新結晶形態的晶狀艾拉莫德1-5種晶體,其吸熱轉變在約236-240℃。 | |
儀器 | PE-983G紅外光譜儀 |
樣品製備 | KBr壓片 |
新結晶形態晶狀艾拉莫德1-5種晶體(溴化鉀壓片)的紅外光譜波數為(厘米)為 | 在約3342、3276、3123、3065、2869、1687、1621、1531、1489、1425、1358、1264和1156厘米有特徵性譜帶 |
儀器 | YTR-3型熔點儀(天津大學精密儀器廠) |
新結晶形態晶狀艾拉莫德1-5種晶體熔點為237-238℃。
該發明製備1-5種結晶形態艾拉莫德的方法,包括將艾拉莫德原料加入結晶化溶劑中,加熱、回流、過濾,濾液室溫放置冰櫃18-24小時,過濾,濾餅洗滌,50-60℃減壓乾燥,製得晶狀艾拉莫德。其中所述的結晶化溶劑選自(1)乙醇(2)乙腈(3)二甲基甲醯胺(4)丙酮(5)二氯甲烷。
結晶形態艾拉莫德理化性質及其藥效學研究
一、艾拉莫德1-5種結晶形態的穩定性
取1-5種結晶形態的艾拉莫德於稱量瓶中,分別於60℃、4500±500勒克斯光照,和75%相對濕度下放置,於5天、10天取樣,HPLC法測定有關物質,結果如表1:
放置條件 | 時間 | 原有粉末 | 新形態1-5 |
雜質總量% | 雜質總量% | ||
/ | 0天 | 未檢出 | 未檢出 |
60°C | 5天 | 0.064 | 0.31 |
光照 | 10天 | 0.072 | 0.48 |
光照 | 5天 | 0.018 | 0.10 |
60°C | 10天 | 0.040 | 0.19 |
92.5%濕度 | 5天 | 0.016 | 0.09 |
92.5%濕度 | 10天 | 0.010 | 0.11 |
結論:1-5種結晶形態的艾拉莫德在60℃、4500±500勒克斯光照和92.5%相對濕度下放置10天,有關物質均未見明顯增加。
二、大鼠口服艾拉莫德五種晶型原料後的藥代動力學
該發明提供了風濕關節炎的治療方法,該方法是對患者給與藥理學上有效量的結晶形態的艾拉莫德。
該發明的結晶形態艾拉莫德在製備治療風濕關節炎藥物方面顯現出較高的生物活性。
試驗材料和方法
1.受試原料:天津藥物研究合成的艾拉莫德乙醇晶型、乙腈晶型、丙酮晶型、二甲基甲醯胺晶型、二氯甲烷晶型。
2.分組給藥:選用Wistar大鼠30隻,按體重隨機分為5組,每組6隻,雌雄兼用,禁食16小時後,各組分別口服灌胃艾拉莫德五種晶型(乙醇晶型、乙腈晶型、丙酮晶型、DMF晶型、二氯甲烷晶型),劑量各為10毫克/千克。分別於給藥後0.17、0.5、1、2、3、4、6、8、12、18和24小時眼眶取血,分離血清,-20℃保存待測。
3.色譜條件
固定相:DiamonsilC18柱,10微米,250×4.6毫米(I.D.),柱溫30℃。
流動相:乙腈:0.1%磷酸=40:60,流速:1毫升/分鐘。
檢測波長:257納米,靈敏度:0.005AUFS。
進樣量:20微升。
4.血樣處理
取大鼠血清200微升,加入內標(艾拉莫德中間體200微克/毫升)10微升,混勻後加入DMF(N、N-二甲基甲醯胺)200微升,振盪10分鐘,放置30分鐘,以10000轉/分鐘的速度離心10分鐘,取上清液20微升進樣。
5.血藥濃度測定:測定標準曲線後,得出直線回歸方程(y=ax+b)。測定大鼠給藥後血樣所得峰面積的比值,根據直線回歸方程計算出血藥濃度,並經3P97藥代計算程式計算藥代參數。
6.儀器
HPLC測試系統:島津SPD-10AUv檢測器,Hi-TechP4000高壓泵,LabAllianceAS1000自動進樣器,ANASTAR色譜工作站。
HT-230A柱溫箱:天津市恆奧科技發展有限公司生產。
TGL-16G台式高速離心機:上海安亭科學儀器廠製造。
WX-80A微型旋渦混合儀:上海滬西分析儀器廠生產。
7.研究結果
藥物 | 藥物Cmax(納克/毫升) | AUC(0-Tn)(納克·小時/毫升) | Tpeak(分鐘) |
形態1-5 | 1783.8±359.4 | 4863.2±1332.3 | 45±9.5 |
原粉末 | 1904.0±683.4 | 4955.0±1533.3 | 60±59.2 |
註:表中數據為平均數±標準差(n=6)
結論:大鼠口服艾拉莫德五種晶型原料後的藥代動力學研究表明,大鼠口服灌胃10毫克/千克的艾拉莫德五種晶型,從藥代參數可見,五種晶型的不同參數之間存在一定差異,但基本都在同一個數量級範圍內,五種晶型均可以開發成新的藥物,五種晶型的結構穩定,在動物體內的吸收、消除基本一致。
該發明提供的藥物組合物含有結晶形態的艾拉莫德和藥學上可接受的載體。
該發明結晶形態的艾拉莫德,適於口服給藥製劑,如片劑包括速釋片、咀嚼片、分散片、泡騰片、緩釋片、控釋片、腸溶片等;膠囊劑包括硬膠囊、軟膠囊、緩釋膠囊、控釋膠囊、腸溶膠囊等;顆粒劑包括混懸顆粒、泡騰顆粒、腸溶顆粒、緩釋顆粒、控釋顆粒等;口服溶液劑;口服混懸劑;糖漿劑等等。該發明的艾拉莫德微粉,還適於外用製劑如凝膠劑、軟膏劑、乳膏劑、糊劑、貼劑等等的製備。製備口服固體製劑時,可將艾拉莫德和適宜藥用輔料製成顆粒裝袋或裝入明膠膠囊或壓製成片。
藥理學上可接受的載體包括一種或多種藥用賦形劑,例如粘合劑、稀釋劑、崩解劑、防腐劑、分散劑、助流劑和潤滑劑。組合物可含12.5-125毫克(通常為25-75毫克)的結晶形態的艾拉莫德。該組合物經口給藥的最佳形式為片劑,片劑一般每片含12.5-125毫克(通常為25-75毫克)的結晶形態的艾拉莫德。最佳為每片含25毫克結晶形態的艾拉莫德。
附圖說明
圖1是形態1的結晶的XRD圖;
圖2是對形態1的結晶進行差示掃描量熱測定而得到的差示熱分析圖;
圖3是形態1的結晶的紅外光譜圖;
圖4是形態2的結晶的XRD圖;
圖5是形態3的結晶的XRD圖;
圖6是形態4的結晶的XRD圖;
圖7是形態5的結晶的XRD圖。
權利要求
1.一種艾拉莫德結晶形態,所述的艾拉莫德結晶形態使用Cu-Ka輻射,以度2θ表示的X射線粉末衍射圖譜在26.00、24.56、20.80、19.56、17.54、10.92和6.88有峰,其特徵在於,所述的X射線粉末衍射圖譜如圖1所示。
2.一種製備權利要求1所述艾拉莫德結晶形態的方法,其特徵在於,將艾拉莫德原料加入乙醇中,經加熱、回流、過濾,將濾液室溫放置或冷凍18-24小時,過濾,濾餅洗滌,50-60°C減壓乾燥,製得所述的艾拉莫德結晶形態。
3.一種藥物組合物,其特徵在於,所述組合物包含權利要求1所述的艾拉莫德結晶形態和一種或多種藥用賦形劑。
4.如權利要求3所述的藥物組合物,其特徵在於,所述的一種或多種藥用賦形劑選自粘合劑、稀釋劑、崩解劑、防腐劑、分散劑、助流劑和潤滑劑。
5.如權利要求3或4所述的藥物組合物,其特徵在於,所述的藥物組合物為口服製劑或外用製劑。
6.如權利要求5所述的藥物組合物,其特徵在於,所述口服製劑選自:片劑、膠囊劑和顆粒劑。
7.如權利要求5所述的藥物組合物,其特徵在於,所述口服製劑為口服溶液劑或口服混懸劑。
8.如權利要求5所述的藥物組合物,其特徵在於,所述口服製劑為糖漿劑。
9.如權利要求5所述的藥物組合物,其特徵在於,所述外用製劑選自:凝膠劑、軟膏劑、乳膏劑、糊劑和貼劑。
10.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為片劑,所述片劑選自:速釋片、緩釋片和控釋片。
11.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為片劑,所述片劑為分散片。
12.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為片劑,所述片劑選自咀嚼片、泡騰片和腸溶片。
13.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為膠囊劑,所述膠囊劑為硬膠囊或軟膠囊。
14.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為膠囊劑,所述膠囊劑為緩釋膠囊或控釋膠囊。
15.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為膠囊劑,所述膠囊劑為腸溶膠囊。
16.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為顆粒劑,所述顆粒劑為混懸顆粒或泡騰顆粒。
17.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為顆粒劑,所述顆粒劑為腸溶顆粒。
18.如權利要求6所述的藥物組合物,其特徵在於,所述的藥物組合物為顆粒劑,所述顆粒劑為緩釋顆粒或控釋顆粒。
19.權利要求1所述的艾拉莫德結晶形態或權利要求3-18中任一項所述的藥物組合物在製備用於治療關節炎的藥物中的套用。
20.如權利要求19所述的套用,其特徵在於,所述的關節炎為風濕關節炎。
實施方式
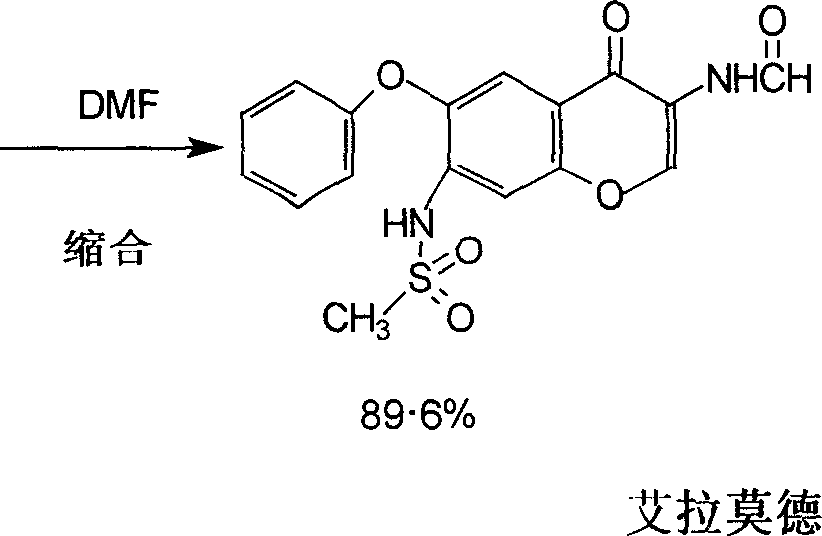
按照Chem.Pharm.Bull.48<1>131-139.2000.和日本專利No97840的敘述,以4-氯-3-硝基苯甲醚為起始原料,與苯酚反應,生成4-苯氧基-3-硝基苯甲醚,鐵粉還原反應得4-苯氧基-3-氨基苯甲醚,經甲磺醯氯醯化反應生成3-甲磺醯胺-4-苯氧基苯甲醚,再與氨基乙腈鹽酸鹽反應,經醯化、環和,共7步反應製備艾拉莫德。合成路線如下:

實施例1
形態1製備:取艾拉莫德10克置入2000毫升園底燒瓶中,加入1000-1500毫升分析純乙醇及活性炭,加熱、回流、過濾,濾液室溫放置18小時,過濾,濾餅洗滌,50-60℃減壓乾燥,得9.8克形態1,熔點237-238℃。
形態1的XRD圖在約26.00、約24.56、約20.80、約19.56、約17.54、約10.92和約6.88有峰,其DSC吸熱轉變在約236-240℃;該紅外吸收光譜(IR)(KBr,厘米)在約3342、3276、3123、3065、2869、1687、1621、1531、1489、1425、1358、1264和1156厘米有特徵性譜帶,見圖1-3。
實施例2
形態2製備:取艾拉莫德10克置入1000毫升園底燒瓶中,加入500-1000毫升分析純乙腈及活性炭,加熱、回流、過濾,濾液室溫放置24小時,過濾,濾餅洗滌,50-60℃減壓乾燥,得9.5克形態2。熔點237-238℃。
形態2的XRD圖在約24.48、約22.60、約21.76、約19.52、約10.84、約18.08、約17.56、約16.92、約11.20、約9.36、約8.64、約7.48、約6.84、約6.52和約5.60有峰,其DSC吸熱轉變在約236-240℃;該IR(KBr,厘米)在約3342、3276、3123、3065、2869、1687、1621、1531、1489、1425、1358、1264和1156厘米有特徵性譜帶,差示熱分析圖,紅外光譜圖與形態1相同,見圖2-3。
實施例3
形態3製備:取艾拉莫德10克置入100毫升園底燒瓶中,加入20毫升分析純二甲基甲醯胺及活性炭,加熱、回流、過濾,濾液室溫放置冰櫃18小時,過濾,濾餅洗滌,50-60℃減壓乾燥,得9.5克形態3。熔點237-238℃。
形態3的XRD圖在約27.28、約25.68、約25.24、約24.40、約24.04、約23.08、約20.16、約17.52、約10.56和約6.00有峰,其DSC吸熱轉變在約236-240℃;該IR(KBr,厘米)在約3342、3276、3123、3065、2869、1687、1621、1531、1489、1425、1358、1264和1156厘米有特徵性譜帶,差示熱分析圖,紅外光譜圖與形態1相同,見圖2-3。
實施例4
形態4製備:取艾拉莫德10克置入2000毫升園底燒瓶中,加入1000毫升分析純丙酮及活性炭,加熱、回流、過濾,濾液室溫放置18小時,過濾,濾餅洗滌,50-60℃減壓乾燥,得9.7克形態4。熔點237-238℃。
形態4的XRD圖在約20.72、約19.52、約18.88、約17.56、約10.84、約9.04和約6.80有峰,其DSC吸熱轉變在約236-240℃;該IR(KBr,厘米)在約3342、3276、3123、3065、2869、1687、1621、1531、1489、1425、1358、1264和1156厘米有特徵性譜帶,差示熱分析圖,紅外光譜圖與形態1相同,見圖2-3。
實施例5
形態5製備:取艾拉莫德10克置入2000毫升園底燒瓶中,加入1000毫升分析純二氯甲烷及活性炭,加熱、回流、過濾,濾液室溫放置18小時,過濾,濾餅洗滌,50-60℃減壓乾燥,得9.7克形態5。熔點237-238℃。
形態5的XRD圖在約28.00、約26.08、約25.64、約24.36、約23.6、約22.92、約22.56、約20.64、約20.00、約19.52、約18.32、約17.60、約16.36、約11.52、約9.32和約6.00有峰,其DSC吸熱轉變在約236-240℃;該IR(KBr,厘米)在約3342、3276、3123、3065、2869、1687、1621、1531、1489、1425、1358、1264和1156厘米有特徵性譜帶,差示熱分析圖,紅外光譜圖與形態1相同,見圖2-3。
實施例6
結晶形態的艾拉莫德片劑製備
一.處方:艾拉莫德25克、微晶纖維素(PH-101)70.7克、羧甲基澱粉鈉37克、微晶纖維素(PH-302)46.6克、十二烷基硫酸鈉3.7克、硬脂酸鎂2克,製成1000片。
二.製備過程
將艾拉莫德原料藥研磨,過200目篩,濾過,抽乾,60℃乾燥,檢查有關物質,即得。取處方量的微晶纖維素(PH-101)、羧甲基澱粉鈉、十二烷基硫酸鈉、硬脂酸鎂過100目篩;微晶纖維素(PH-302)過80目篩。將處方量的微晶纖維素(PH-101)、十二烷基硫酸鈉及1/2處方量的羧甲基澱粉鈉混勻,過80目篩3遍。用分步稀釋法將艾拉莫德與均勻的輔料研磨混勻,過60目篩三次。加20%HPMC60%的乙醇溶液適量,以20目篩制粒。置60℃乾燥,以30目篩整粒,稱重確定其餘輔料加入量,加其餘輔料1/2處方量羧甲基澱粉鈉、微晶纖維素(PH-302)、硬脂酸鎂,混合均勻,過20目篩3次。取樣測定含量及有關物質,定片重,壓片,製成片劑。
溶出度測定:
照《中國藥典》2000版二部(附錄XC第二法)要求依法操作,以磷酸鹽緩衝液(0.05摩爾/升pH8)1000ml為溶劑,調整轉速為每分鐘100轉,於5、10、20、30、45、60分鐘取樣,紫外分光光度法測定,樣品的溶出度結果如下:
樣品 | 5分鐘 | 10分鐘 | 20分鐘 | 30分鐘 | 45分鐘 | 60分鐘 |
1 | 80.17 | 91.80 | 99.07 | 101.1 | 102.0 | 102.4 |
2 | 79.75 | 92.42 | 98.23 | 100.3 | 101.1 | 101.1 |
3 | 78.92 | 83.07 | 98.03 | 98.65 | 99.27 | 99.90 |
4 | 74.56 | 90.76 | 98.23 | 98.23 | 99.69 | 99.27 |
5 | 76.22 | 95.12 | 99.69 | 100.1 | 100.1 | 101.8 |
實施例7
艾拉莫德速釋片的製備
一.處方
處方組成 | 樣品1 | 樣品2 | 樣品3 |
艾拉莫德形態1-3 | 25克 | 25克 | 25克 |
乳糖 | 50克 | 25克 | 50克 |
微晶纖維素 | 50克 | 50克 | 25克 |
/ | 37.5克 | / | |
交聯殺甲基纖維素鈉 | 20克 | 20克 | 24克 |
十二烷基硫酸鈉 | 4.5克 | 5克 | / |
適量 | 適量 | 適量 | |
3克 | 3克 | 2.3克 | |
製成 | 1000片 | ||
二.製備過程
(1)將原、輔料粉碎分別過200目篩,備用。
(2)除聚維酮K30、硬脂酸鎂外,按處方稱取處方量,60目篩混合均勻,加10%PVP-K30溶液制軟材,30目篩制粒,60℃乾燥2小時。
(3)取上述顆粒,加入處方量的硬脂酸鎂,20目篩整粒。壓片,控制壓力3~4公斤。
溶出度測定:
照中國藥典2000年版要求,以磷酸鹽緩衝液(pH為7.8)為溶出介質,漿法,轉速為100轉/分,紫外分光光度法測定,樣品1、樣品2及常規片溶出度測定結果如下:
取樣時間(分) | 釋放量(%) | |||
樣品1 | 樣品2 | 樣品3 | 常規片 | |
2 | 93.9 | 75.0 | / | / |
5 | 99.0 | 96.0 | 90.0 | 63.4 |
10 | 99.4 | 99.6 | 98.7 | 78.3 |
15 | 96.8 | 100.9 | / | / |
20 | 95.3 | 100.2 | 101.0 | 88.1 |
30 | / | / | 99.0 | 96.4 |
45 | / | / | / | 100.3 |
60 | / | / | / | 102.3 |
榮譽表彰
2014年11月6日,《艾拉莫德結晶形態及其組合物》獲得第十六屆中國專利優秀獎。

