艾博定(克拉屈濱注射液),本總可試用於經干擾素治療失敗後活動性的伴有臨床意義的貧血、中性粒細胞減少、血小板減少以及疾病相關症狀的毛細胞白血病(HCL)治療。
基本介紹
- 藥品名稱:克拉屈濱注射液
- 漢語拼音:Ke La Qu Bin Zhu She Ye
- 用途分類:其他血液系統用藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,批准文號,生產企業,修訂日期,
成份
本品的主要成份為克拉屈濱,其化學名稱為2-氯-6-氨基-9(2-脫氧-β-D-赤型-呋喃戊基糖)嘌呤。
化學結構式: 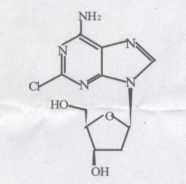

分子式:C10H12ClN5O3
分子量:285.69
輔料:氯化鈉。
性狀
本品為無色或幾乎無色的澄明液體。
適應症
本總可試用於經干擾素治療失敗後活動性的伴有臨床意義的貧血、中性粒細胞減少、血小板減少以及疾病相關症狀的毛細胞白血病(HCL)治療。
規格
10ml:克拉屈濱10mg與氯化鈉90mg
用法用量
靜脈滴注。治療多毛細胞白血病時的建議劑量為克拉屈濱0.09/kg/d,作24小時的連續滴注,連用7天。不推薦其它的用藥方案。根據己有經驗,如患者對初始療程無效,增加療程不會獲得更大利益。臨用前按計算量從安瓿中抽取克拉屈濱注射液,加入到貯有500ml10.9%氯化鈉注射液的瓶中(或袋內),混勻後作靜脈滴注。全部程式須嚴格按無菌操作常規進行,每天配藥一次,供當天靜脈滴注之用。
因為缺乏足夠的配伍試驗,不推薦與其它稀釋液配伍使用。
不良反應
因為缺乏在中國人使用的安全性數據。
安全性數據來源於國外196位毛細胞白血病患者:起初的124位患者,加最初入選截至後在相同兩中心入選的其他72位患者。毛細胞白血病患者的第1個月臨床研究提示,嚴重中性白細 胞減少率為70%,發熱率為69%,感染率為28%。開始治療的第一個14天內經常報導的其他不 良反應包括:疲勞( 45%〉、噁心(28%〕、皮疹( 27%)、頭痛( 22%)和注射部位反應(19%)。大多 數非血液學不良反應為輕至中度。
開始治療的第一個月經常觀察到骨髓抑制。70%的患者出現中性粒細胞減少(ANC<500X106/L﹚.而最初的發生率為26%。37%的患者出現嚴重貧血〈血紅蛋白<8.5g/dl〕,而最初的發生 率為10%。12%的患者出現血小板減少(血小板<20 X 109/L〉,而最初的發生率為4%。
治療第一個月54/196〈 28%〉的患者出現感染。6%的患者出現嚴重感染(例如敗血症、肺炎)餘下的為輕或中度。幾位患者的死亡應歸因於感染和成與疾病有關的併發症。治療第二個月感染的全部發生率為6%;這些感染為輕至中度感染,未出現嚴重的系統感染。三個月後每月感染 發生率均小於或等於治療前的發生率。
治療第一個月11%的病人出現產重發熱(例≥104OF)。不到1/3的發熱患者出現感染。參與試驗的196位患者中有19位於治療前一個月出現感染。治療第一個月54位患者出現感染:23位(42%〉為細菌性感染,11位(20%)為病毒性感染,11位(20%)為真菌性感染。7/8的帶狀皰疹患 者發病於治療第一個月。14/16的真菌感染患者發病於治療開始的2個月。實際上所有感染病人都據經驗進行抗生素治療。
淋巴細胞分析顯示,克拉屈濱的治療與CH4計數的長時間減少有關。治療前平均CD4計數為766/ul。平均CH4計數的最低值為272/ul,發生於治療的第4 -6個月。治療後15個月,平均 CD4計數<500ul0雖然外月後才觀察到CD8計數增加,但總的來說CD8與CH4的變化趨勢相似。 目前尚不淸楚CD4淋巴細胞長時間減少的臨床意義。
另一未知臨床意義的不良反應為骨供細胞長時間過少。兩項關鍵的臨床試驗表明,4個月後42/124(34%)患者的骨期細胞構成<35%。細胞過少最近發生於第1010天。目前尚不淸楚細胞 過少是骨髓纖維化引起還是克拉屈濱毒性引起。對外周血細胞計數無明顯臨床影響。
大多數皮疹均較輕微,且發生於正接受或最近已接受可引起皮疼藥物治療(例別嘌醇或抗生素)的患者。
大多數患者的噁心也較輕微,不伴隨嘔吐,不需用止吐劑治療。應及早控制需用止吐劑治療患者的噁心,最常用藥物為氯丙嗪。
治療開始2周內出現的發生率≥5%的不良反應(不論是否與藥物有關)包括:
全身系統:發熱( 69%)、疲勞( 69%)、寒戰( 9%)虛弱( 9%)、發汗( 9%)、不適( 7%)、軀幹痛( 6%)
胃腸道系統:噁心( 28%)、食慾減退(17%)、嘔吐( 13%)、腹瀉( 10%)、便秘(9%)腹痛( 6%)血/淋巴系統:紫癜( 10%)、瘀點( 8%)、鼻衄( 5%)
神經系統:頭痛( 22%)、頭昏( 9%)、失眠(7%)
心血管系統:水腫( 6%)、心動過速( 6%)
呼吸系統:異常呼吸音(11%)、咳嗽( 10%)、異常胸音(9%)、呼吸短促( 7%)
皮下組織:皮疹( 27%)、注射部位反應(19%)、瘙癢( 6%)、紅斑( 6%)
肌肉骨骼系統:肌痛( 7%)、關節痛(5%)
與靜脈注射有關的不良反應包括:注射部位反應(例變紅、腫脹、疼痛),血栓形(2%)、 靜脈炎( 2%)、導管破裂(1%)、這些不良反應由輸入過程和域內在導管(而不是藥物或溶媒)引起。
從第15天到最後的隨訪,發生率大於5%的不良反應包括:疲勞(11%)、皮疹( 10%)、頭痛(7%)、咳嗽(7%)、不適(5%)
下面對藥物大批供應後出現的不良反應進行描述。這些不良反應主要的都已在接受多療程克拉屈濱注射液治療的不良反應中報導過:
血液學:伴有長時間各類血細胞減少的骨髄抑制,包括再生障礙性貧血發生於治療後幾周的溶血性貧血^在淋巴樣惡性腫瘤患者體內報導過〕。
肝:膽紅素和轉氨酶出現可逆的輕微增加。
神經系統:神經病學毒性然而,按克拉屈濱注射液的標準給藥方案治療很少有嚴重神經毒性的報導。
呼吸系統:肺間質浸潤為大多數病人感染的病因。
皮膚/皮下組織:蕁麻疹,嗜曙紅細胞過多。正接受或最近已接受可引起這些綜合症的其他藥物。例如嗓醇或抗生素胎療的患者出現過Stevens-Johnson和毒性表皮壞死松解。
由於克拉屈濱注射液可傳遞免疫抑制,所以治療急性期可出現機會感染。
禁忌
對本品過敏的患者禁用。
注意事項
1、本品為有效抗腫瘤藥,同時也具有嚴重的潛在毒副作用。因此,本品應在三級甲等醫院使用,應在有抗腫瘤治療經驗的臨床醫生指導下使用。
2、在用本品治療的患者^特別是高劑量時通常可觀察到嚴重骨髓抑制,包括中性白細胞減少、貧血和血小板減少。參與臨床研究的大多數患者在治療開始時都具有血液學損害(為毛細胞白血病活動期的臨床表現)用本品治療後,外周血計數恢復前血液學呈現進一步損傷。治療開始的第一個2周內,平均血小板計數、ANC和血紅蛋白濃度下降,然後分別於第12天、第5周 和第8周增至正常值。治療的第一月應著重注意本品的骨髄抑制作用。治療的第1個月有44、 的患者補充肪仁8,14免的患者補充血小板。因此,本品從給藥開始最初4至8周內,除了連續注意患者的體徵變化外,須定期作血液學檢査,以便及時發現患者是否出現貧血、中性白細胞減少、 血小板減少以及潛在繼發的感染或出血。與使用其他有效化療藥一樣,應監測患者,特別是肝、 腎功能失調患者納肝、腎功能。
3、治療中和治療後,應定期監測患者的血液學以檢測骨期造血功能抑制程度。臨床研究中所有細胞計數出現可逆性減少後,於第12天平均血小板計數達100 X 109幾,第5周平均絕對中性 白細胞計數達1500x106/L,第8周平均血紅蛋白達12g/dl.外周血計數恢復正常後,應進行骨髓吸引術和活檢以確定本品的療效。應進行適當的實驗室和放射學研究以調査發熱不良反應。應 定期對腎和肝功能進行檢測。
4、本品對於骨髗造血功能的抑制基本上是劑量依賴性和可逆性的,可在1- 2個月內逐漸恢復。如遇嚴重情況,應按有關治療原賕如輸注血液成分、給予抗生棄等座善處理。
5、治療的第一個月,大約2/3的患者(131/196)因使用本品而出現發熱(131/196)。總的來說,47蟻(131/196)納患者同時出現中性白細胞減少(131/196)湘發熱,其中62位(131/196)偽嚴重中 性白細胞減少患者(131/196)。由於發熱大多發生於中性白細胞減少患者,治療的第一個 月應緊密監測這類患者並根據經驗進行抗生素治療。雖然69%、的患者出現發熱,但不到1/3的發 熱副作用由感染引起。已知本品具有骨髄抑制作用,醫生應權衡感染期患者使用本品的危險和 利益。
6、目前尚無足夠數據顯示肝或腎功能不全患者的用藥劑童。大劑量使用本品的患者有急 性腎功能損傷的報導。本品應慎用於骨髓、免疫及肝、腎功能不良的患者。懷疑有腎或肝功能不全的患者也應慎用本品。
7、其他血液惡性腫瘤患者經本品治療後很少有腫瘤溶解綜合症的報導。
8、在劑量爬坡研究中最高劑量組(大約為推薦用量的備)觀察到外周軸索多發性神經病,患者並未接受環孢菌素或全身放療治療.但一般按推薦的標準劑量方案給藥,很少出現嚴重的神經毒性。
9、本品不得以含有葡萄糖的注射液作為稀釋劑,因葡萄糖可以促進克拉屈濱的分解。本品的輸液中不得隨意加入其他藥物。
10、由於本品為潛在的細胞毒藥物,因此處理、配置和使用本品時都應加以注意。
孕婦及哺乳期婦女用藥
動物試驗的結果表明,本品可致胚胎死亡或發生畸變。除在絕對需要的情況之外,不得將本品用於孕婦。建議育齡婦女避免懷孕。尚未確知本品是否可隨乳汁分泌。因為許多藥物都會經乳汁排泄,並且克拉屈濱存在潛在對胎兒的危害。哺乳期婦女如需使用本品,應停止哺乳。
兒童用藥
兒童使用本品的安全性與有效性尚未充分確定。
老年用藥
因為臨床研究中未包括足夠的65歲以上人群,尚不能確定他們的反應是否與年青人不同。 老年患者對本品的骨髄抑制和腎臟毒性等比較敏感,應謹慎用藥。
藥物相互作用
尚不明確克拉屈濱與其它藥物的相互作用。
給予本品期間如同時使用對骨髓造血功能、免疫功能和腎功能有損害作用的藥物,可能加重本品在這些方面的毒性。
藥物過量
給藥過量可以引起不可逆性神經損害〈下半身或四肢輕癱〉、急性腎損害〈腎功能衰竭〉嚴重骨髓抑制〈中性粒細胞減少、貧血、血小板減少〉等毒性反應。發生本品中毒時應立即停藥, 採取適當的支持治療措施。尚不明確是否可用血液透析法以除去體內藥物。無特異性解毒藥。
臨床試驗
尚缺乏在中國人套用的臨床研究資料。
國外已在需治療的、處於毛細胞白血病活動期的患者體內進行了克拉屈濱注射液的2項開 放單中心臨床研究。89位病人參與Scripps臨床教學和研究基地的研究〈研究A〉,給藥方案為靜脈注射克拉屈濱注射液0.09mg/kgX 7da.35位病人參與從及安德森癌症中心的研究〔研究B〕 給藥方案為靜脈注射的克拉屈濱注射液。完全反應(CR)的標準為:外周血和骨髄毛細胞被淸除,血紅蛋白恢復至12g/dl,血小板計數為100x109/L,絕對中性粒細胞計數為 1500 x 106/L。好的部分反應(GPR)標準為:血液學參數與完全反應的一致,骨髄毛細胞剩餘量小於5%。部分反應(PR)標準為:骨髄毛細胞至少降低50%,且血液學參數與完全反應一致。病理復發標準為:骨髄毛細胞增至治療前的25%。臨床復發標準為:血細胞減少復發,特別是,血紅蛋白降低值≥2g/dl,絕對中性粒細胞計數(ANC)降低值≥25%或血小板計數降低值多≥50000。 如果發現符合完全反應標準的病人隨後出現骨髄毛細胞(<治療前的25%),我們將其歸類為部分反應而不是完全反應的復發。
可評價有效性的患者(N=106〉,用上述血液學和骨髄反應標準評價其反應率,克拉屈濱注射液治療後研究A和研究B的完全反應率分別為65%和68%,產生的聯合完全反應率為66%。研究A和研究B的全部反應率(例完全反應十好的部分反應十部分反應分別為89%和86%,聯合全部反應率為88%。
使用ITT(intention-to-treat)分析,且CR標準需有無脾腫大的依據(例體檢時無可觸及脾和CT 掃描≤13cm),研究A和研究B完全反應率分別為54%和53%,聯合完全反應率為54%。研究A和研究B的全部反應率(CR+GPR+PR)分別為90%和85%,聯合全部反應率為89%。
這些研究中,60%的病人之前未對毛細胞白血病進行過化療,也未進行過脾切除術治療,且接受克拉屈濱注射液作為一線治療。餘下的40%病人之前用其他藥物(包括以α一干擾素和/或噴司他丁)進行過治療,本品的治療為二線治療。之前未化療病人的全部反應率為92%,之前已治療病人的全部反應率為84%。克拉屈濱注射液對之前已治療病人仍有效;然而回顧性分析提示,脾切除術病人或已經噴司他丁、以α-干擾素治療病人的全部反應率有所降低。
可逆性衰退期後,92%可評價病人的外周血細胞計數達正常值(血紅蛋白〉12.0g/dl,血小板)100 X 109/L,絕對中性粒細胞計數(ANC) >1500 X 106/L).外周血細胞計數正常化的中位時間為9周(範圍:2-72〉。血小板計數正常化的中數時間為2周,ANC正常化的中位時間為5周,血紅蛋白正常化的中位時間為8周。完全反應病人的血小板計數和血紅蛋白正常化1個月和2個月後 應取消血小板和RBC的輸液。少數嚴重基礎血小板減少患者的血小板恢復時間可能延長。與正常化一致的是,與用克拉屈濱注射液治療前幾個月相比,三個月後感染髮生率呈降低趨勢。
完全反應病人反應〈例骨髄、外周血無毛細胞和外周血參數正常化〉中位時間〔治療開始 時測量)大約為4個月。由於骨髄吸引術和活組織檢査未經常在外周血正常化時進行,所以實際上完全反應的中數時間可能比記錄的時間稍短。試驗截止時完全反應的中數持續時間為8-25 個月。93位反應病人在試驗截止時有7位的疾病有所進展,4位無外周血異常(病理過程),僅局限於骨髄,3位病人出現外周血異常(臨床過程).7位對克拉屈濱注射液第一療程無反應的病人接受了第二療程的治療。有足夠隨訪、附加療程的5位病人未改善其全部反應。
藥理毒理
藥理作用:
克拉屈濱的抑瘤活性與脫氧胞苷激酶和脫氧核苷酸激酶活性有關。它主要以被動轉運進入細胞,在細胞內被脫氧胞苷激酶磷酸化,轉化為克拉屈濱三磷酸,摻合到DNA分子中,妨礙DNA斷裂後的修復作用,造成NAD和ATP的耗竭,破壞細胞代謝,影響細胞的DNA合成。因此本 品對分化或靜止期的淋巴細胞和單核細胞均有抑制DNA合成和修復的作用。
毒理研究:
遺傳毒性:本品可造成DNA損失,引起哺乳動物細胞DNA鏈的斷裂。本品可進入到人淋巴白細胞。在體外的Ames試驗和中國倉鼠細胞染色體畸變試驗中和體內的小鼠骨髄微核試驗中,本品顯示為DNA的斷裂劑。
生殖毒性:獼猴靜脈給藥,本品可引起精子細胞的生成抑制,但對人體生育力的影響不淸楚。本品屬妊娠D級的藥品。
致癌性:未進行本品的動物致癌試驗研究,但根據遺傳毒性研究結果不排除本品的致癌性可能。
藥代動力學
尚缺乏克拉屈濱按目前臨床推薦劑量用藥時的中國人藥代動力學資料。
國外一項臨床研究中入選腎功能正常的毛細胞白血病患者17名,按克拉屈濱 0.09mg/kg/d的劑量連續靜滴7日以上,測得平均穩態濃度為5.7ng/ml,總清除率為663.5ml/kg/h。對毛細胞白血病患者而言,本品的血清濃度和最終臨床結果間未建立相關關係。
另一項研究中包括各種血液惡性病患者8名,克拉屈濱按0.12mg/kg的劑量作2小時的靜滴。 滴注完畢時的平均血漿濃度為48± 19ng/ml。可用雙相或三相消除模型解釋克拉屈濱在其中5位患者體內的消除過程。腎功能正常患者的終末半衰期為5.4h,淸除率為978±422ml/kg/h,穩態分 布容積為4.5±2.8L/kg。本品可以透過血腦屏障,腦脊液中的濃度約為血漿濃度的25%。血漿蛋白結合率約為20%。
除已知的細胞毒作用機制外,目前尚不清楚本品在人體的代謝情況。實體瘤患者,按克拉 屈濱3.5–8.1mg/m2/d的劑量連續靜脈滴注5日,其尿排泄率平均為18%。目前尚未在腎功和肝功損傷患者體內進行克拉屈濱的消除研究。
貯藏
密閉、陰涼(不超過20℃)處保存。
包裝
鈉鈣玻璃模製注射劑瓶,1瓶/盒。
有效期
暫定18個月。
執行標準
YBH33322005
批准文號
國藥準字H20052240
生產企業
浙江海正藥業股份有限公司
修訂日期
2007年6月21日
