釋義
把
天然水中粒徑在1~10nm的各種微小粒子都劃為膠體範圍,是因為它們都具有膠體的性質。這些微小粒子可以是細小的黏土顆粒,也可以是溶質分子的集合體或分子量比較大的高分子化合物。
黏土顆粒和溶質分子的集合體都占有一定的體積和面積,由於它們不溶於水,所以與水之間存在相間分界面,組成一個微多相
分散體系,也稱動力學不穩定體系。
高分子化合物與水組成的分散體系,在水中處於溶解狀態,與周圍水之間沒有分界面,屬於單相體系,也稱熱力學穩定體系。
天然水體雖然是一種由多種膠體顆粒共存的體系,但其中以黏土礦物質及
腐殖質最為普遍。黏土微粒是造成天然水體混濁的主要物質,其中粒徑大於10μm的主要是石英、長石、雲母等原生礦物顆粒,粒徑小於10μm的主要是
高嶺石、
蒙脫石等次生礦物顆粒,後者是混凝處理的主要對象。
主要特性
1、 水中分散顆粒的穩定性
顆粒直徑大於0.1mm以上的細砂,可藉助重力在2min以內除去。而顆粒直徑小於0.001mm的細粒黏土,沉降速度非常緩慢。當顆粒直徑達到膠體大小時,實際上已不可能自行沉降,它們能長時間在水中保持懸浮分散狀態,這種現象統稱為“分散顆粒的穩定性。”因為從水處理的觀點,凡沉降速度緩慢的顆粒都不可能在停留時間很短的水處理設備中沉降分離出來,所以認為它們在水中均是穩定的。
2、 動力穩定性
分散於水中的各種懸浮顆粒,隨時都受到水分子熱運動的撞擊。當懸浮顆粒直徑比較大時,每一個顆粒從各個方向同時受到水分子的數次撞擊,所以各個方向的撞擊力可以相互平衡抵消,使這種顆粒能在重力作用下沉降分離。當顆粒直徑小至膠體範圍時,每一個顆粒受到水分子撞擊的次數較少,各個方向的撞擊力在瞬間內達不到平衡,朝合力的方向不斷高速位移,運動的軌跡是不規則的,這種運動被稱為“
布朗運動”。另外,由於這種顆粒質量很輕,重力沉降作用甚微,從而導致膠體顆粒處於均勻的分散狀態,這稱為膠體顆粒的動力穩穩定性。這是黏土顆粒能長期穩定存在於水中,致使天然水體產生混濁的主要原因。布朗運動的速度與顆粒的直徑大小有關,粒徑越大,布朗運動的速度就越小,當顆粒直徑達到3~5μm以上時,布朗運動就停止了。
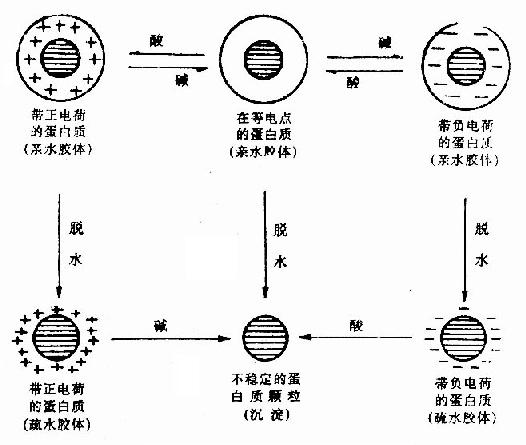
3、 膠體顆粒的帶電現象
如果將膠體顆粒的水溶液加入一支U形管中,兩端插入電極並接直流電源,可見到水中膠體顆粒向某一個電極方向遷移和濃集,說明這些膠體顆粒是帶電的。有的膠體顆粒向正極方向移動,如黏土顆粒、細菌及蛋白質一類的高分子有機化合物,說明它們帶有負電荷;有的膠體顆粒向負極方向移動,如金屬鋁和鐵的氫氧化物等,說明它們帶有正電荷。由於膠體顆粒的這種帶電現象,使相同的膠體顆粒之間產生靜電斥力,這種靜電斥力的大小決定於兩個膠體顆粒所帶電荷的數目和相互問的距離,並與兩個膠體顆粒間距的平方成反比。如果膠體顆粒之間的靜電斥力大於它們之間的范德華爾茲引力,它們之間就會產生相互排斥作用,不能相互凝聚,而長期穩定地存在於水中。
4、 膠體顆粒的溶劑化作用
膠體顆粒按其對溶劑(水)的親合力強弱,分為親水性膠體和憎水性膠體。親水性膠體在水中保持穩定性的原因是在膠體顆粒表面上有一個具有一定厚度的水膜。水膜具有定向排列結構,當兩個親水性膠體顆粒相碰時,水膜被擠壓變形,但因水膜有力圖恢復原定向排列結構的能力,而使水膜具有彈性,從而使兩個相碰撞的膠體顆粒“擦肩而過”,而不凝聚。天然水體中的親水膠體主要是一些高分子的有機化合物,在其分子結構中含有帶正電的—NH4或帶負電的-COO等極性基團。它們具有吸附大量水分子的能力,在其表面形成一個水膜,增加了這種膠體顆粒在水中的穩定性。憎水膠體顆粒在水中的穩定性在於它的帶電性,這可由雙電層結構來說明。
脫穩方法
1、 投加電解質
天然水中的黏土膠體顆粒一般均帶負電荷,當向水中投加帶高價反離子的
電解質後,水中反離子濃度增大,水中膠體微粒的擴散層在反離子的壓縮作用下減薄,
電位下降,使膠粒間的相互作用
勢能發生變化。當ζ電位降到零時,膠粒間的排斥勢能完全消失,此時的膠粒處於完全脫穩狀態,膠粒間的吸引勢能達到最大值,膠粒很容易凝聚。ζ電位等於零時的狀態稱為等電點狀態。實驗研究表明,
凝聚不一定在ζ電位降至等電點時才開始發生,而在電位值約為0.01~0.03V時,排斥勢能已降低到足以使膠粒相互接近的程度,此時在吸引力的作用下,膠粒開始凝聚,這一ζ電位值是膠體顆粒保持穩定的限度,稱為臨界電位值。試驗表明,投加的電解質,其反離子價數越高,脫穩效果越好。
2、 投加帶相反電荷的膠體
當向水中投加帶相反
電荷的膠體後,水中膠體顆粒與加入的相反電荷的膠粒之間發生電性吸附和電性中和作用,使兩種膠體顆粒的ζ電位都降低或消失,從而發生
脫穩凝聚作用。為了使兩種膠體脫穩凝聚,必須控制適當的投加量,投加量不足時,膠粒仍保持一定的ζ電位值,凝聚效果不佳,投加量過高時,又會因原來的膠體脫穩後形成的微小絮凝體具有較大的吸附能力,能吸附過量的相反電荷的膠體而重新帶電(帶上相反電荷),從而使原膠粒發生再穩定,影響凝聚效果。
3、 投加高分子絮凝劑
高分子
絮凝劑是一類水溶液性的線形高分子聚合物,分子呈鏈狀,每一鏈節是一個化學單位。若聚合物單體上含有可離解的基團,則稱為聚合電解質。當高分子絮凝劑投加到水中後,開始時某一個鏈節的官能團吸附在某一膠粒上,而另一個鏈節伸展到水中吸附在另一個膠粒上,從而形成一個“膠粒高分子絮凝劑-膠粒”的絮凝體,即高分子絮凝劑在兩個顆粒之間起到一個吸附架橋的作用