病害學史
1936年Greig首次描述了衣原體流產,並命名為母羊地方性流產(EAE)。當時他提出這是環境因素如飲食不足的結果。
1950年,Stamp和他的同事們才證明這是一種有機體引起的傳染病。
20世紀60年代中期,鑑定了衣原體菌株的特定表型特徵。
病原特徵
流產衣原體引起的地方性流產是世界範圍內綿羊地方性流產的主要原因。以前,人們認為綿羊和山羊的所有衣原體疾病,包括流產、多關節炎和結膜炎,都是由鸚鵡熱衣原體引起的,並且該微生物也可以在沒有疾病臨床症狀的綿羊的腸道中發現。流產衣原體以前稱為鸚鵡熱衣原體免疫型(Chlamydia psittaci immunotype / serovar 1),現已被證明是與鸚鵡熱衣原體不同且獨立的生物體。
衣原體包括13個種,即流產衣原體沙眼衣原體、鸚鵡熱衣原體、反芻動物衣原體豬衣原體、家禽衣原體、鳥衣原體、貓衣原體、肺炎衣原體、鼠衣原體、豚鼠衣原體、蛇隱孢子蟲和C.poikilothermis,羊衣原體病主要是由流產衣原體感染引起的,反烏動物衣原體、肺炎衣原體和鸚鵡熱衣原體偶爾也可引起羊只發病間,流產衣原體對熱較敏感,在低溫條件存活時間較長(0℃可以存活數周,-70℃能夠長期保存),對紅黴素和四環素族等敏感,對磺胺類和鏈黴素具有較強的抵抗力,使用2%的來蘇水溶液5分鐘就可將其滅活。
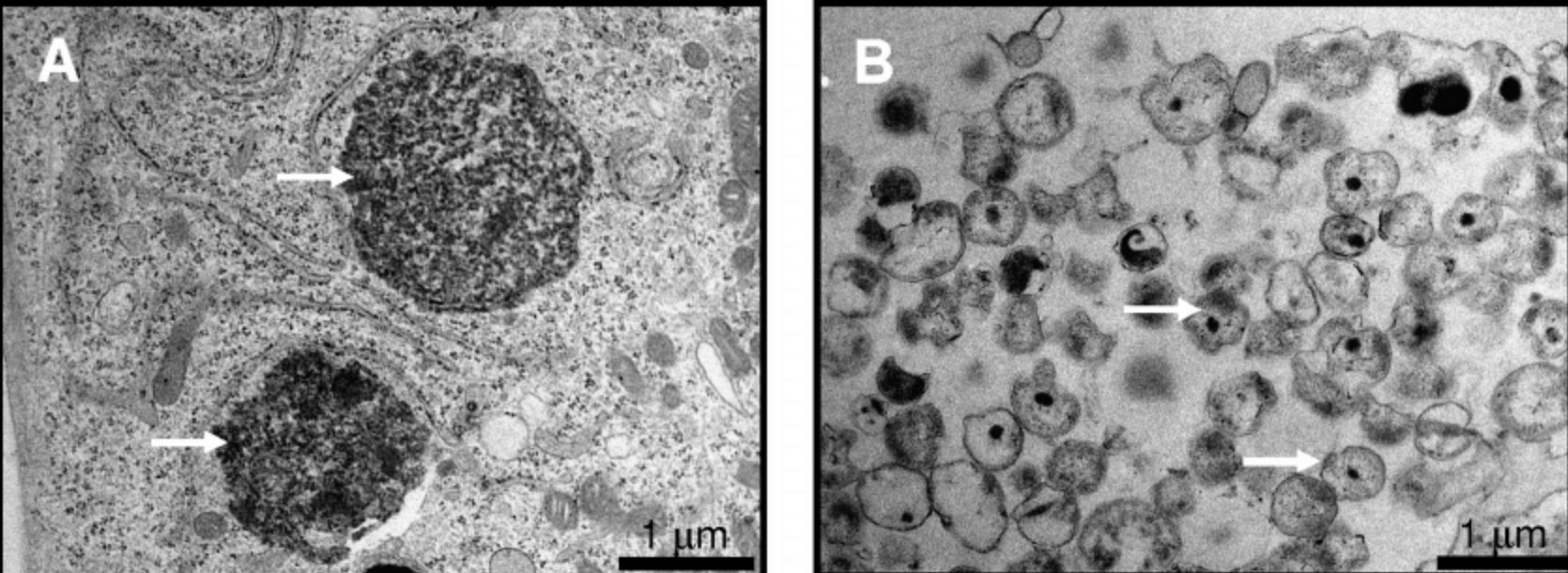
流產衣原體的透射電鏡觀察
(A)RB(箭頭),在感染後24小時在McCoy細胞內的直徑為1微米的細胞。(B)在感染後72小時從McCoy細胞收穫的純化EB(箭頭),直徑為300-500納米。
為害症狀
哺乳母羊乳腺腫大、變硬,乳房淋巴結腫大,子宮內膜糜爛與潰瘍。流產胎兒大小均勻,皮膚完整皮下組織有不同程度的點狀出血與水腫,水腫尤以臍部、腹股溝部、鼻背、腦後最為嚴重。腹腔腹水量增加,並被血紅蛋白著染。唾液腺、胸腺、心臟、肺臟漿膜下點狀出血。肝臟腫大、充血,有時可見針尖大小的灰白色病灶與纖維素沉著。這些病變主要取決於感染時的胎齡。在子宮內死亡已久的胎兒表現不同程度的自溶,難以辨別生前的病變。胎兒胎盤病變與布魯菌病病變相似,絨毛膜部分或大部分脫落,殘存的絨毛膜水腫、絨毛葉之間含有血性滲出物,絨毛葉呈紫紅色或灰白色,表面出現特徵性棕褐色壞死。
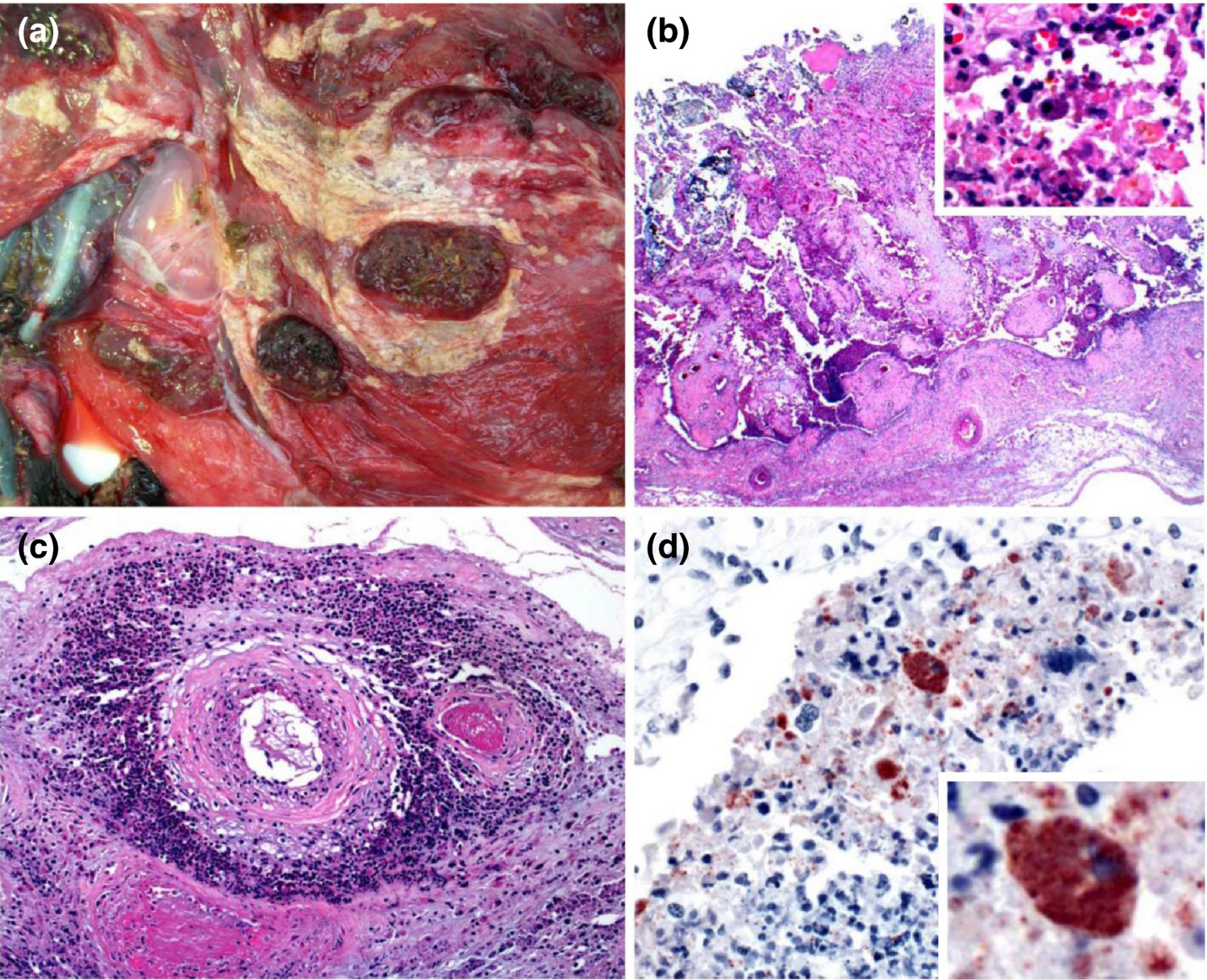
綿羊地方性流產為害症狀
(a)胎盤絨毛膜側的大體視圖。膜增厚,有廣泛的多灶性至聚結性纖維素膿性滲出物。(b)絨毛尿囊膜壞死,伴有嗜酸性細胞和核壞死碎片、活的和變性的中性粒細胞、較少的巨噬細胞和多灶性礦化。插圖:高倍鏡顯示炎性細胞和滋養層細胞,有無數胞質內包涵體。(c)絨毛尿囊膜內的動脈顯示出血管炎、血栓形成以及活的和退化的中性粒細胞、巨噬細胞、淋巴細胞和漿細胞在血管周圍的積聚。(d)絨毛膜絨毛顯示具有無數胞質內包涵體的滋養層,對流產衣原體染色陽性。還有細胞外陽性物質。插頁:高倍放大顯示陽性染色的滋養層。
流行情況
自然感染的潛伏期為50~90天。後期羊流產、死產或產下弱羔是本病突出的臨診表現,主要見於妊娠30~120天后感染的母羊。產蓋或流產後,母羊出現發熱,體溫高達41.3~42.0℃,稽留一星期以上,陰道排出少量棕灰色或棕紅色分泌物。哺乳母羊泌乳量明顯下降或停止,乳汁變質,含有親衣原體與大量中性粒細胞。有的發生胎盤滯留,並繼發細菌性子官內膜炎而死亡。無繼發病時母羊的生殖器官迅速恢復,不影響繁殖功能,對親衣原體的再感染具有終生免疫力。妊娠早期的母羊、空懷母羊以及羔羊多呈隱性感染,直至下一次或再下一次產羔期出現流產。
診斷方法
臨床診斷
該病臨床上可分為流產型、關節炎型和結膜炎型,且這3種表型常在一個羊群中同時出現或先後出現。
流產型
潛伏期為2~3個月不等,主要發生於懷孕後期尤其是產前最後一個月的母羊表現為流產、死產或產出弱羔,排出胎衣和惡露所需時間較長,子宮不能及時閉合,引發繼發感染,造成羊只體溫升高、食欲不振,發生過流產的母羊一般不再流產,產出的弱蓋一般不會存活,種公羊有時表現為睪丸發炎,其他成年羊則病症出現較少。
關節炎型
多發生於夏秋季節。1~8月齡的病羔羊主要表現為四肢關節尤其是腕關節和附關節腫脹、疼痛,造成羊只行,弓背站立,嚴重的病羊還表現為臥地不起,同時還伴有結膜炎症狀,嚴重影響了羊的發育。
對於結膜炎型
羊衣原體病常發生於綿羊特別是綿羔羊,病羊主要表現為單隻眼或雙隻眼流淚,結膜充血、水腫、角膜混濁,進一步發展則造成糜爛、潰瘍或穿孔,一般經過治療2~4天后開始癒合好轉。
實驗室診斷
除了羊衣原體病,羊的布魯氏菌病、彎曲桿菌病、羊流感等也可造成羊的流產,因此僅靠臨床症狀不能做出判斷,還需藉助實驗室診斷才能確診。
病原學檢測
主要包括染色法和病原分離培養法,染色法即在無菌的條件下採集病死羊的血液、氣管分泌物、脾臟、肺臟、腸黏膜和腸內容物、流產胎兒、流產分泌物等病料,製作流產胎兒和臟器的切片以及其他病料的塗片,再用姬姆薩染色法進行染色,最後在顯微鏡下觀察可以看到經染色呈紅色或紫紅色的區域為衣原體原生小體(具有感染能力),經染色為藍綠色區域為的衣原體網狀體(不具有感染性);病原分離法即將適量的病料懸液接種於孵化的雞胚(5~7日)卵黃囊內,觀察可發現胚胎於3~5日死亡,然後取一些卵黃囊製作抹片進行鏡檢,可以看到大量的衣原體。
血清學檢測
動物衣原體病常用的血清學檢測方法包括補體結合實驗、酶聯免疫吸附實驗(ELISA)、間接血凝實驗,補體結合實驗操作繁瑣、費時,在實驗結果的判定上具有一定的主觀性,對實驗人員技術水平要求較高,且流產衣原體和假單胞菌屬等一些細菌有共同的抗原,易出現假陽性,也不能區分自然感染和免疫接種;對於ELISA方法,操作簡單、檢測快速、敏感性高,但由於衣原體脂多糖類抗原有些表位與其它革蘭氏陰性細菌相同,也易出現交叉反應和假陽性,也不能區分自然感染和免疫接種,且商品化ELISA試劑盒檢測結果間存在差異;間接血凝實驗操作簡便、不需要使用儀器,適用於基層獸醫站大規模的檢測、疫情監測及流行病學調查,但敏感性低也不能區分自然感染和疫苗免疫。不同的檢測方法優缺點不同,所適用的檢測範圍也不同,具體可參照現行《動物衣原體病診斷技術》(NYT 562-2015)進行選擇使用。
分子生物學檢測
動物衣原體分子生物學檢測技術包括聚合酶鏈式反應(PCR)螢光定量PCR和多重光定量PCR,其中PCR檢測技術(主要是針對病原外膜蛋白和16-23SrRNA靶基因進行檢測),敏感性和特異性方面相當於或高於病原分離法,能快速對羊衣原體病做出診斷而螢光定量PCR、多重螢光定量PCR等方法也在檢測流產衣原體、貓衣原體和沙眼衣原體中得到了一定程度的研究和套用,雖然,PCR方法已列入現行衣原體病診斷技術標準中,但該實驗需要使用的昂貴儀器(PCR儀、螢光PCR儀、凝膠成像系統)對實驗條件、環境和操作人員也都有較高的要求,基層實驗室基本無法滿足,這對羊衣原體病的診斷帶來了一定的影響。
防治措施
加強飼養管理:做好環境衛生,無害化處理病死動物;注意氣候變化確保畜舍通風良好;提高飼料營養水平。合理調整飼養密度。
做好消毒工作:堅持每天對欄舍、過道、器具、場內死角消毒;每周對場內環境消毒兩次。嚴禁外來人員進出場區,工作人員進場必須要更換工作服,經消毒通道進場工作。
免疫接種:生產實際中可在母羊配種前接種一次油佐劑苗,可以使母羊獲得3個懷孕期的保護力。
防止病毒傳入:引種應來自非疫區,並嚴格對引進的種羊隔離飼養。經實驗室檢測無病原存在方可混群飼養。
治療:臨床上可對患病羊注射四環素族抗生素,也可口服,連用2周左右有較好的治療效果。對於結膜炎型的病羊還可配合使用土黴素軟膏來點眼。



