精細平衡原理,化學反應動力學中的一個基本原理。內容是在一個處於化學平衡的反應系統中,每一個元反應都與其逆向元反應具有相同的反應速率。
基本介紹
- 中文名:精細平衡原理
- 領域:化學
- 特點:相同的反應速率
- 原理:微觀可逆性原理
簡介,分析,
簡介
例如,一物質在同一相中有三個異構體A1、A2、A3,且能相互轉化。當三者濃度不再隨時間而變化,即反應系統已達到平衡時,(a)式所代表的三個對峙反應的正、逆向速率均相等的情況是合理的,符合精細平衡原理。而(b)式所代表的循環平衡(cyclic equilibrium)雖然也能使各物質濃度不再隨時間而變化,但卻是不合理的,違反精細平衡原理。精細平衡原理是微觀可逆性原理運用於巨觀的化學平衡系統時所得到的必然結果。
分析
表述為:當一總包反應達到平衡時,其中每一組對峙反應也必須達到平衡。也就是說,當總包反應達到平衡時,不僅各組元的濃度不變,而且其中每一組對峙反應的正向和逆向反應的反應速率也相等。一簡單的對峙反應體系達到平衡狀態後,如果體系中各組元的濃度恆定不變,則正向反應速率和逆向反應速率相等。對於複雜的對峙反應體系,當體系中各組元濃度恆定不變時,從原則上講,並不必須所有對峙反應的正向反應和逆向反應的速率相等。例如,對以下三角反應:如各組對峙反應的正向和逆向反應速率r差值相等:即可保持各組元 A1、A2、A3 的濃度不變。對上述三角反應來說,根據精細平衡原理,不僅要求正向反應和逆向反應的反應速率差值相等,而且要求其差值為零。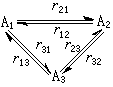 三角反應
三角反應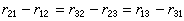 精細平衡原理
精細平衡原理
 三角反應
三角反應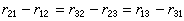 精細平衡原理
精細平衡原理利用精細平衡原理,對於上述三角反應,我們可由其中任意兩組對峙反應的平衡常數求得第三組對峙反應的平衡常數。例如,A1與A3之間的平衡常數K31應等於A1與 A2之間的平衡常數K21和A2與A3之間的平衡常數K32之積,即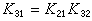 精細平衡原理
精細平衡原理
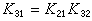 精細平衡原理
精細平衡原理