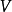基本介紹
- 中文名:米氏方程
- 外文名:Michaelis-Menten equation
- 研究對象:酶促反應
- 類型:速度方程
- 別稱:米-曼式方程
米氏方程,方程推導,建立模型,模型假設,推導過程,模型改進,參數意義,雙倒數圖,抑制作用,競爭性抑制,非競爭性抑制,反競爭性抑制,
米氏方程
n(飽和時)=Vmax=k[E][S]0=k[E]total=k cat[ES]
速度常數k等於催化常數k cat,k cat是ES轉化為游離的E和產物的速度常數。飽和時,所有的E都是以ES存在。方程(3.2)中還有另一個簡單的關係式:Vmax=k cat [E]total。從中得出:k cat=Vmax / [E]total。k cat的單位是s-1。催化常數可以衡量一個酶促反應的快慢。
方程推導
建立模型
1913年Michaelis L.和Menten M.根據中間複合體學說提出了單底物酶促反應的快速平衡模型或平衡態模型(equilibrium-state model),也稱為米-曼氏模型(Michaelis-Menten model):
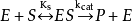
式中E是酶,S是底物,ES是中間複合體,P是產物, 是ES的解離[平衡]常數,即第一步的逆向反應中的速率常數
是ES的解離[平衡]常數,即第一步的逆向反應中的速率常數 和正向速率常數
和正向速率常數 之比
之比 ,
, 是催化常數,即第二步中的向前速率常數
是催化常數,即第二步中的向前速率常數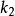 。
。





模型假設
在建立模型和推導模型的速率方程時,他們實際上做了以下幾點假設:
①為了簡化起見,假設反應中只有一個中間複合體,反應的第一步 是可逆反應,並保持始終;
是可逆反應,並保持始終;

②反應的第二步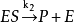 是限速步驟,這裡是限速步驟,這裡
是限速步驟,這裡是限速步驟,這裡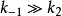 ,也就是說ES分解生成P的速率不足以破壞E和ES之間的快速平衡;
,也就是說ES分解生成P的速率不足以破壞E和ES之間的快速平衡;
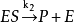
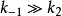
③為了達到平衡,只用初始底物濃度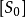 的很小一部分,因為一般情況下
的很小一部分,因為一般情況下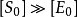 (初始酶濃度),因此在反映的初期,底物濃度[S]可以用
(初始酶濃度),因此在反映的初期,底物濃度[S]可以用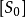 代替,或是把[S]看作
代替,或是把[S]看作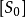 ;
;
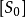
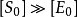
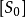
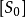
④酶在反應中不被消耗,只是或以游離形式E存在或以結合形式ES存在,因此游離酶濃度[E]和中間複合體濃度[ES]只和等於初始酶濃度 或總酶濃度
或總酶濃度 ,即
,即 ,這就是所謂的酶守恆公式(conservation equation of enzyme);
,這就是所謂的酶守恆公式(conservation equation of enzyme);



⑤該模型沒有考慮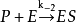 這一逆反應,但顯然
這一逆反應,但顯然 是一個不等於零的常數,要忽略這一步,必需使[P]接近於零,因此米-曼氏方程只適用於反應的初速率。
是一個不等於零的常數,要忽略這一步,必需使[P]接近於零,因此米-曼氏方程只適用於反應的初速率。
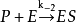

推導過程
根據平衡態模型S轉變成P的總速率應由限速反應(模型中第二步)決定,因此產物生成速率

ES複合體的濃度[ES]在實驗上不易測定,需要找出容易測定的其他參數(如某些常數和已知的 等)來代替它。為此利用第一步反應(快速平衡)中ES解離成E和S的解離常數
等)來代替它。為此利用第一步反應(快速平衡)中ES解離成E和S的解離常數


則

將酶守恆公式 代入上式得
代入上式得

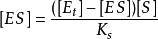
經整理得

代入 得
得

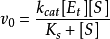
這裡 具有特殊的意義。當底物濃度[S]高至使所有酶分子都被飽和時,則
具有特殊的意義。當底物濃度[S]高至使所有酶分子都被飽和時,則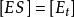 ,反應初速率
,反應初速率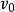 將達到最大值,
將達到最大值, 用數學式可表示為
用數學式可表示為

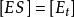
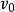

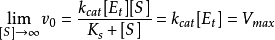
因此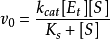 也可寫成
也可寫成
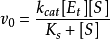

模型改進
平衡態模型中前兩點假設不具有普遍性,特別是沒有理由認為所有酶促反應的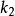 都遠小於
都遠小於 。因此1925年Briggs G. E.和Haldane J. B. S.對該模型提出了修正,但仍保留米-曼氏假設的後三點。他們用穩態模型(steady-state model)或稱Briggs-Haldane氏模型:
。因此1925年Briggs G. E.和Haldane J. B. S.對該模型提出了修正,但仍保留米-曼氏假設的後三點。他們用穩態模型(steady-state model)或稱Briggs-Haldane氏模型:
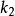

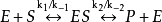




因為 且
且


所以

整理得
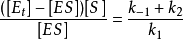
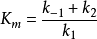
將 代入
代入 ,整理得:
,整理得:


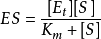
根據穩態模型,S轉變為P的速率決定於穩態濃度[ES]和限速的速率常數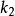 。因此
。因此
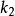

將 代入上式,得
代入上式,得

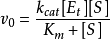
或

根據兩種模型推導出的速率方程形式上是一樣的,兩者不同的是 比
比 具有更大的普遍性。穩態下,當
具有更大的普遍性。穩態下,當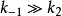 時,則
時,則 ,因此可以把平衡態看成是穩態的一個特例。為了紀念Michaelis和Menten兩人,人們把上述帶三角符號的的方程都稱為米-曼氏方程(Michaelis-Menten equation)。
,因此可以把平衡態看成是穩態的一個特例。為了紀念Michaelis和Menten兩人,人們把上述帶三角符號的的方程都稱為米-曼氏方程(Michaelis-Menten equation)。


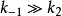

參數意義
①當 時,
時, 。因此,Km等於酶促反應速度達最大值一半時的底物濃度。
。因此,Km等於酶促反應速度達最大值一半時的底物濃度。


②當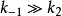 時,
時, =Ks。因此,Km可以反映酶與底物親和力的大小,即
=Ks。因此,Km可以反映酶與底物親和力的大小,即 值越小,則酶與底物的親和力越大;反之,則越小。
值越小,則酶與底物的親和力越大;反之,則越小。
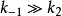


③ 可用於判斷反應級數:當[S]<0.01Km時,ν=(Vmax/Km)[S],反應為一級反應,即反應速度與底物濃度成正比;當[S]>100Km時,ν=Vmax,反應為零級反應,即反應速度與底物濃度無關;當0.01Km<[S]<100Km時,反應處於零級反應和一級反應之間,為混合級反應。
可用於判斷反應級數:當[S]<0.01Km時,ν=(Vmax/Km)[S],反應為一級反應,即反應速度與底物濃度成正比;當[S]>100Km時,ν=Vmax,反應為零級反應,即反應速度與底物濃度無關;當0.01Km<[S]<100Km時,反應處於零級反應和一級反應之間,為混合級反應。

④ 是酶的特徵性常數:在一定條件下,某種酶的Km值是恆定的,因而可以通過測定不同酶(特別是一組同工酶)的Km值,來判斷是否為不同的酶。
是酶的特徵性常數:在一定條件下,某種酶的Km值是恆定的,因而可以通過測定不同酶(特別是一組同工酶)的Km值,來判斷是否為不同的酶。

⑤ 可用來判斷酶的最適底物:當酶有幾種不同的底物存在時,Km值最小者,為該酶的最適底物。
可用來判斷酶的最適底物:當酶有幾種不同的底物存在時,Km值最小者,為該酶的最適底物。

⑥ 可用來確定酶活性測定時所需的底物濃度:當[S]=10Km時,ν=91%Vmax,為最合適的測定酶活性所需的底物濃度。
可用來確定酶活性測定時所需的底物濃度:當[S]=10Km時,ν=91%Vmax,為最合適的測定酶活性所需的底物濃度。

⑦ 可用於酶的轉換數的計算:當酶的總濃度和最大速度已知時,可計算出酶的轉換數,即單位時間內每個酶分子催化底物轉變為產物的分子數。
可用於酶的轉換數的計算:當酶的總濃度和最大速度已知時,可計算出酶的轉換數,即單位時間內每個酶分子催化底物轉變為產物的分子數。

雙倒數圖
酶促反應中的 和
和 值有幾種測量方法。固定反應中的酶濃度,然後分析幾種不同底物濃度下的起始速度,就可獲得
值有幾種測量方法。固定反應中的酶濃度,然後分析幾種不同底物濃度下的起始速度,就可獲得 和
和 值。但直接從起始速度對底物濃度的圖中確定
值。但直接從起始速度對底物濃度的圖中確定 或
或 值是很困難的,因為曲線接近
值是很困難的,因為曲線接近 時是個漸進過程。所以通常都是利用米氏方程的轉換形式求出
時是個漸進過程。所以通常都是利用米氏方程的轉換形式求出 和
和 值。常用的米氏方程轉換形式是Lineweaver-Burk方程,也稱為雙倒數方程。
值。常用的米氏方程轉換形式是Lineweaver-Burk方程,也稱為雙倒數方程。









使1/ v 對1/[S]作圖,可以獲得一條直線。從直線與x軸的截距可以得到1/ 的絕對值;而1/Vmax是直線與y軸的截距。雙倒數作圖直觀、容易理解,為酶抑制研究提供了易於識別的圖形。
的絕對值;而1/Vmax是直線與y軸的截距。雙倒數作圖直觀、容易理解,為酶抑制研究提供了易於識別的圖形。

缺點:底物濃度低時,坐標點集中於坐標左下方,使得誤差增大,往往偏離直線, 、
、 無法精確定出。
無法精確定出。


解決方法:底物濃度配成1/[S]的濃度級差,而不是[S]的濃度極差,使點距離平均,再以最小二乘法線性回歸分析。
抑制作用
競爭性抑制


非競爭性抑制


反競爭性抑制