基本介紹
- 中文名:碘化鈣
- 英文名:Calcium iodide
- 別稱:無水碘化鈣
- 化學式:Cal2
- 分子量:293.89
- CAS登錄號:10102-68-8
- EINECS登錄號:233-276-8
- 熔點:575
- 沸點:718
- 水溶性:極易溶於水
- 密度:3.956
- 外觀:無色或黃白色粉末
- 套用:主要用於醫藥,是碘化鉀的代用品
物化性質,穩定性,合成方法,貯存方法,用途,計算化學數據,
物化性質
穩定性
碘化鈣在常溫常壓下穩定。避免光,明火,高溫。極易溶於水、甲醇、乙醇、丙醇;不溶於乙醚,溶於乙醇和丙酮。熔化熱為41.80 kJ/mol。有很強的吸濕性,易潮解。在100g水的溶解度為208.5g(20℃)。為防止見光分解,要裝入有色瓶中,並隔絕 和
和 。
。


合成方法
1、接合成法:
按碘:硫酸:硫化鈉:氧化鈣:蒸餾水=1:0.75:0.75:1:3.3的重量配比,先將硫化鈉加水製成30%溶液,然後在攪拌下滴入50%稀硫酸,至呈微酸性(pH=6),生成的硫化氫氣用蒸餾水洗滌。將碘加入蒸餾水,邊攪拌邊通入硫化氫,吸收器外用水冷卻,壓力保持在0.049MPa以下,吸收溫度25~30℃,使碘完全溶解,並與硫化氫反應,生成乳白色碘化氫溶液,過濾後再加入預製好的氫氧化鈣至呈鹼性(pH7.5~8),經過濾,得到碘化鈣溶液。加入活性炭進行脫色,過濾,加熱至200℃進行濃縮,然後用水稀釋至相對密度1.54,靜置過夜。過濾,再加熱至218~230℃蒸發濃縮,急速用冰水冷卻(速度宜快,否則變黃),破碎後,製得碘化鈣成品。
2、碘化亞鐵法:將蒸餾水加入反應器中,在攪拌下加入已清除油污的鐵屑,分次加入碘,反應過程中控制溫度不超過40℃,直至碘完全溶解,然後加入蒸餾水,緩慢加熱至沸,使碘和鐵屑充分反應。然後分次加入消石灰至pH值為14。再加熱至沸,攪拌1h,使碘化亞鐵和氫氧化鈣充分反應,生成碘化鈣。冷卻至50℃放料,經離心分離後得到濾液,再將濾餅與一倍量的水混合、煮沸,經冷卻、離心分離,把兩次濾液合併後進行精製。濾液用氫碘酸調節pH至2~3,於220~230℃下蒸發濃縮、冷卻、破碎,製得碘化鈣成品。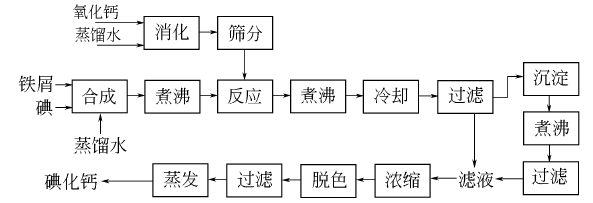 碘化亞鐵法工藝流程圖
碘化亞鐵法工藝流程圖
 碘化亞鐵法工藝流程圖
碘化亞鐵法工藝流程圖3、加熱脫水法:
將六水結晶碘化鈣在乾燥氮氣流中加熱脫水,經急冷卻,粉碎,製得無水碘化鈣。其反應方程式如下:

4、碘與鐵屑反應生成碘化亞鐵,再與氫氧化鈣作用,生成碘化鈣,經分離過濾、濃縮、脫色、蒸髮結晶而得。或者由硫化氫和碘作用,得到碘化氫,碘化氫再與氫氧化鈣或碳酸鈣反應得到碘化鈣溶液,將該溶液加熱濃縮、冷卻結晶即可。
5、取35g碳酸鈣加20mL水攪拌均勻,沿杯壁滴加53mL氫碘酸至碳酸鈣完全溶解。加入稀氫氧化鈣溶液調節pH值至6~6.5,若有碘析出,可加 水溶液消除碘的顏色。如有沉澱就過濾。濾液在石棉網上加熱濃縮。在真空乾燥器中冷卻,有三水合碘化鈣析出。向三水合物中按10%~15%加入碘化銨,在氫氣流中加熱至250℃,除去溶於結晶水中的空氣,再加熱至700℃熔融之後,冷卻即得無水碘化鈣的透明結晶。
水溶液消除碘的顏色。如有沉澱就過濾。濾液在石棉網上加熱濃縮。在真空乾燥器中冷卻,有三水合碘化鈣析出。向三水合物中按10%~15%加入碘化銨,在氫氣流中加熱至250℃,除去溶於結晶水中的空氣,再加熱至700℃熔融之後,冷卻即得無水碘化鈣的透明結晶。

貯存方法
應貯存在陰涼、通風、避光的庫房內。運輸時要防雨淋和日曬。裝卸時要輕拿輕放,嚴禁振動、撞擊。失火時,可用沙土、二氧化碳滅火器撲救。
用途
1、主要用於醫藥,是碘化鉀的代用品,用於制止咳藥;
2、照相業用作感光乳化劑;
3、還可用作礦泉水、滅火劑、碘化氫的乾燥劑及分析試劑。
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:0
3、氫鍵受體數量:2
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:0
7、重原子數量:3
8、表面電荷:0
9、複雜度:0
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:3


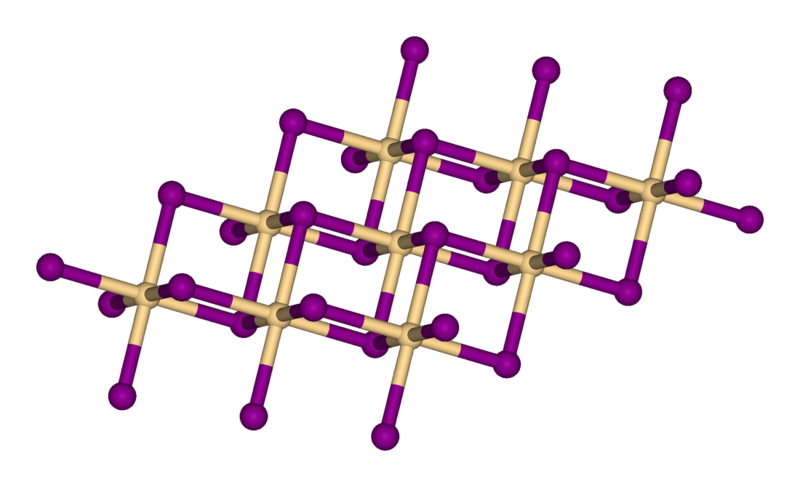 碘化鈣分子結構
碘化鈣分子結構
