狄拜溫度,也稱為德拜溫度或德拜特徵溫度,固態的定容比熱常用此溫度表示θ=ω (h/2π)/k,式中,θ為狄拜溫度,h 為普朗克常數(Planck constant)被 2π 除;k 為波茲曼常數(Boltzmann constant);ω為與固體本身特性有關之角頻率。
基本介紹
- 中文名:狄拜溫度
- 外文名:Debye temperature
- 別名:德拜溫度
定義,性質,相關概念,德拜,德拜力,德拜理論,
定義
狄拜溫度( Debye temperature)指晶體中和原子的最高振動頻率 對應的能量
對應的能量 與波爾茨曼常數
與波爾茨曼常數 的比值。符號Θ,符號為開(K)。以下式表示
的比值。符號Θ,符號為開(K)。以下式表示







性質
固體比熱理論中按照德拜假設分析時產生的一個參量。
在德拜假設下,固體原子振動有一個最高頻率(而實際上沒有),否則固體能量統計值會趨於無限大。經過計算得到,德拜溫度和這一最高頻率之間有直接的關係即:
θ/ω = (h/2π)/k
其中,θ為德拜溫度,ω為最高振動圓頻率,h為Plank常量,k為玻耳茲曼常量。具體地,
ω^3 = 6π^2v^3N/V
其中,v為恆定聲速,N為固體原胞數,V為固體體積。
該名稱因美籍荷蘭物理學家德拜而得名。不同固體的德拜溫度不同。
金屬的德拜溫度越高,原子間作用力越大,膨脹係數越小,楊氏模量越大。
德拜溫度和頻率上限成正比。和一般振動系統類似,原子間相互作用力較強、原子較輕時振動頻率高,因此德拜溫度也高。例如,金剛石的德拜溫度約2050K,鉛原子間相互作用力較弱,而且原子也較重,因此德拜溫度值很低,不到100K,一般元素的德拜溫度值大約在200K到400K。
德拜理論的偏差,反映在由各個溫度下的比熱數值求出的德拜溫度值不是常數,而是德拜溫度隨溫度稍有變化。大多數情況下和平均值的偏差小於10%,個別情況,變化可大於20%(如鋅),詳見“玻恩-豐卡爾曼(Bora. Von Karman)理論。
由於只要一個參數德拜溫度即可描述晶格的振動和比熱的變化,因此不僅德拜理論得到廣泛的套用,德拜溫度也成了一個重要的參數,它不僅出現在比熱中,也出現在一些和晶格振動有關的理論中。德拜溫度也可從固體的彈性、熔點、熱膨脹等數據中定出,相互比較都有一些出入。

相關概念
德拜
德拜( Peter Joseph Wilhelm Debye,1884~1966)美國物理學家,原籍荷蘭。慕尼黑大學哲學博士。曾任烏得勒支大學、格廷根大學、蘇黎世國立工業大學、菜比錫大學、康奈爾大學教授。提出固體比熱理論,得到 理論和隨固體而異的德拜溫度。1916年與瑞士物理學家謝樂(Paul Scherrer,1890~)合作創立晶體粉末的X射線衍射法(德拜-謝樂法),用於研究晶體的結構。還提出關於強電解質溶液的理論、高分子溶液理論、光的散射理論、粘度理論等,指出用絕熱去磁法可獲得極低的低溫。因他提出極化分子理論和對測定分子結構所作的貢獻,獲1936年諾貝爾化學獎。著有《極性分子》等。
理論和隨固體而異的德拜溫度。1916年與瑞士物理學家謝樂(Paul Scherrer,1890~)合作創立晶體粉末的X射線衍射法(德拜-謝樂法),用於研究晶體的結構。還提出關於強電解質溶液的理論、高分子溶液理論、光的散射理論、粘度理論等,指出用絕熱去磁法可獲得極低的低溫。因他提出極化分子理論和對測定分子結構所作的貢獻,獲1936年諾貝爾化學獎。著有《極性分子》等。

德拜力
德拜力( Debye force)也稱“極化作用力”。分子間力的一種。由誘導偶極矩所引起。它們的作用能為:

式中,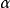 是極化率,
是極化率, 為偶極距,
為偶極距, 為分子間距。
為分子間距。
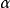


德拜理論
愛因斯坦比熱理論中把各格點的振動看作是完全獨立的。事實上,每一個格點的運動都和周圍的格點緊密相關,應該當作一個整體來看待。德拜(1912年)根據整體運動的特點,把晶格看作是各向同性的連續介質,把晶格的振動看作是連續介質中傳播的彈性波。知道了單位率間隔內的彈性波的支數f(v),頻率為ν的彈性波的平均能量 ,可求出總能量
,可求出總能量


在德拜理論中





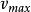

為了簡化比熱公式,引入德拜溫度




按照徳拜理論,只要知道某物質的德拜溫度,即可求出各個溫度下的比熱值,並和實驗基本符合。此方法簡便可靠,因此得到了廣泛的套用。以後的研究發現,徳拜理論仍存在一定的偏差,其原因是忽略了晶格的分立性,仍然是一個比較簡單的模型。

