基本介紹
- 中文名:無熱溶液
- 外文名:Athermal solution
- 定義:混和熱為零的溶液
- 相關方程:Wilson方程、NRTL方程
- 計算量:混合自由焓、過剩自由焓等
- 套用領域:化工熱力學
定義,無熱溶液模型,適用範圍,涉及方程,各種計算,混合自由焓,過剩自由焓,過量Gibbs自由焓,超額熵,
定義
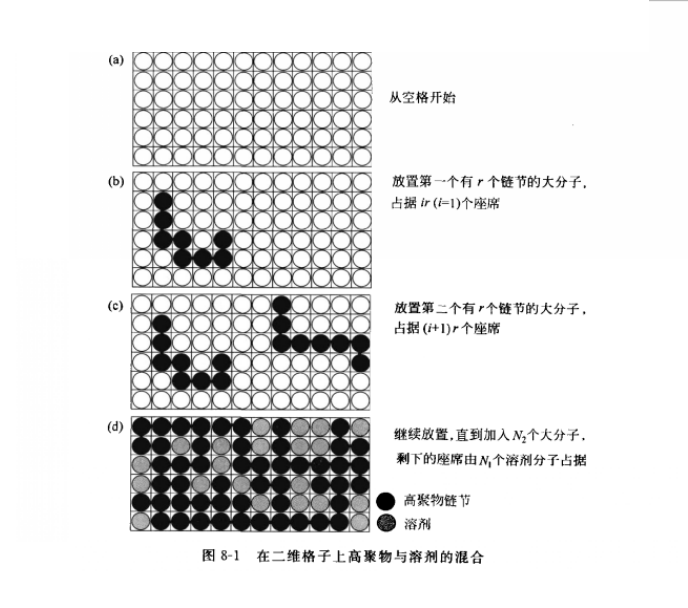
無熱溶液模型
適用範圍
無熱溶液模型適用於由分子大小相差甚遠、而相互作用力很相近的物質構成的溶液,特別是高聚物溶液。由Flory-Huggins方程求得的活度係數往往小於1。因此,無熱溶液模型只能用來預測對Raoult定律呈現負偏差系統的性質,更不能用於極性相差大的系統。
涉及方程
用得最為廣泛的Wilson方程及NRTL方程都是在無熱溶液的基礎上獲得的。
各種計算
混合自由焓
定義



由熱力學理論,可以導得理想溶液的混合自由焓為:

其中,x為摩爾分數。
過剩自由焓
利用公式

和理想溶液混合自由焓的計算公式

把這兩個公式帶入到下面的公式:

可得到由似晶格模型導出的無熱溶液的過剩自由焓公式,如下所示:

或

上述公式只計入組合因子的貢獻,在 的下面加注(c)表示“組合”。
的下面加注(c)表示“組合”。

過量Gibbs自由焓
可通過Flory—Huggins方程計算無熱溶液的過量Gibbs自由焓。該方程具體形式如下:



超額熵
採用統計力學的方法可以得到無熱溶液超額熵的方程:

其中 稱為組分i的體積分數(或節分數)。
稱為組分i的體積分數(或節分數)。