企業文化
公司願景
成為全球領先的創新型跨國製藥企業
公司使命
以患者之需為己任,探索、開發並提供高質量的安全有效藥物和服務,護佑健康
價值觀
科學實證 高效卓越 創新進取 多元融合
公司簡介
海普瑞於1998年成立於深圳,是擁有A+H雙融資平台的領先跨國製藥企業,主要業務覆蓋肝素產業鏈、生物大分子CDMO和創新藥物的投資、開發及商業化。
海普瑞在肝素全產業鏈的各個環節都是領導者。海普瑞旗下依諾肝素鈉注射液銷往全球逾40個國家和地區。。在CDMO領域,公司旗下賽灣生物,具有技術和成功交付能力。在創新藥領域,多項公司擁有市場權益的同類藥物已處於臨床後期,商業化在即。三大板塊業務相互協同,以臨床未滿足需求為驅動,海普瑞致力於為全球患者提供高質量的藥物和服務。
海普瑞在北美、歐洲等地區擁有41家子公司,海普瑞旗下主要的全資子公司之一天道醫藥,在全球7個國家(中國、美國、波蘭、義大利、英國、德國、西班牙)擁有自營業務。
海普瑞旗下主要5家控股公司分別為:深圳市天道醫藥有限公司、深圳昂瑞生物醫藥技術有限公司、深圳市瑞迪生物醫藥有限公司、SPL Acquisition Corp.(SPL)、Cytovance Biologics, Inc.(賽灣生物)。
發展歷程
2000年,海普瑞肝素鈉出口基地正式投產。
2002年,首次通過國家食品藥品監督管理局生產現場GMP認證。
2005年,首次通過美國食品藥品監督管理局(FDA)認證的檢查
2005年,依諾肝素鈉注射液(商品名:普洛靜)作為首個原研仿製藥獲國家藥品監督管理局(當時CFDA,現為NMPA)批准,進入中國市場。
2007年海普瑞改制為股份制公司,為後續獲得資本市場的支持做好了準備。
2008年,百特事件,海普瑞通過美國食品藥品監督管理局(FDA)的兩次現場複查,成為美國標準肝素製劑原料藥供應商,當時95%以上肝素製劑的原料來自海普瑞,有效緩解了這一救命藥的短缺。
2008年,海普瑞公司的肝素鈉獲得歐洲藥典適用性證書(CEP證書)。
2009年,海普瑞參與肝素鈉美國藥典標準的修訂,修訂後的美國藥典標準已於2009年10月1日起公布生效。
2010年,成功在深交所
A股上市,股票代碼為002399。
2014年,收購美國SPL公司(SPL Acquisition Corp.),鞏固了肝素鈉原料藥市場地位。
2014年,構建海普瑞全球化可溯源肝素原料藥生產、研發和銷售體系,並且進入胰酶製品領域,轉向跨國運營階段。
2015年7月,於加拿大投資Resverlogix公司——一家開發治療心腦血管疾病藥物的新藥研發公司。獲得突破性療法藥物apabetalone(RVX-208)在大中華區的所有權益。
2015年,收購北美一流生物大分子藥物開發和生產平台賽灣生物(Cytovance Biologics, Inc.),進軍CDMO業務。
2016年,海普瑞的依諾肝素鈉製劑(商品名:Inhixa/Neoparin)以首個原研生物類似藥在歐盟獲批,並於同年在歐盟建立自營團隊。
2016年,與OncoQuest在中國成立控股合資公司OncoVent,並於2016年推進單克隆抗體oregovomab在大中華區的臨床開發,該藥可用於卵巢癌相關治療。
2018年,全資收購多普樂,完成從原材料到肝素製劑的全肝素產業鏈整合。成為全球最大的
肝素原料藥企業和全球第四大依諾
肝素製劑企業。
2018年,海普瑞與Aridis Pharmaceuticals Inc.共同投資設立合資公司,用以推進Tosatoxumab(AR-301)、AR101兩個品種在大中華區域的開發。
在海普瑞的領導下,賽灣生物首次實現扭虧為盈。
經過前十年的
科學積澱,海普瑞逐漸形成了獨特的創
新藥布局邏輯:在原理上,海普瑞在熟知的
免疫調節領域裡持續開發、尋找、投資創
新藥品種;在病種上,聚焦於因
免疫調節失衡導致的
心血管和
腫瘤疾病;尤其對於臨床中後期產品的工藝開發方面。
為了擴大海普瑞對創新品種的篩選視野和更加精準高效地篩選符合我們布局邏輯的
新藥品種、加速已有管線品種的開發進度,海普瑞早在2012年即開始在全球尋找CDMO平台,
利用人源化小鼠和大數據分析技術平台,篩選、開發和臨床轉化針對自身
免疫疾病和
癌症治療的全人抗體。
在過去的十年里,海普瑞已逐漸成為以
肝素全產業鏈為主,多個穩定增長的現金流業務為基礎,擁有數十個First-in-Class創
新藥管線布局品種,以創新的跨國運營國際製藥企業。
2020年,海普瑞成功在港交所H股上市,股票代碼為09989,開啟A+H雙融資平台時代。
2020年,海普瑞發布公告稱收到國家藥品監督管理局核准簽發的《藥品補充申請批准通知書》,海普瑞在售所有規格依諾肝素鈉注射液(商品名:普洛靜)全部通過中國仿製藥一致性評價,是獲批時中國首個過評的同一品種產品。
2020年,開始為全球大規模上市的兩個mRNA新冠疫苗提供所需關鍵酶的生產服務。
2023年3月16日,海普瑞(002399)公告,公司的全資孫公司天道醫藥近期收到美國食品藥物管理局(簡稱“FDA”)簽發的依諾肝素鈉注射液ANDA批准通知。12月,海普瑞公告,聯營公司君聖泰醫藥擬在香港聯合交易所有限公司主機板發行股份上市。君聖泰的股份將於2023年12月22日開始在香港聯交所主機板買賣。
公司業務
海普瑞的主要業務覆蓋肝素全產業鏈、生物大分子CDMO和創新藥物的投資、開發及商業化。三大板塊業務相互協同促進。
肝素全產業鏈業務
深耕肝素領域20餘年,海普瑞是肝素全產業鏈領導者,海普瑞是中國極少數完成了肝素全產業鏈跨國閉環布局的生物醫藥企業。海普瑞的肝素產品包括原料藥產品和製劑產品。海普瑞旗下依諾肝素鈉注射液的質量受到國際廣泛認可,已在包括美國、歐盟在內的逾40個國家和地區實現銷售。並被納入13大歐盟國家及英國和瑞士的醫保體系。

海普瑞孫子公司-天道醫藥生產的依諾肝素鈉注射液—高度自動化生
除上述市場,海普瑞在
肝素產業鏈上的各產品還在其他數十個國家和地區獲批
上市。同時,隨著對
肝素及其衍生物的分子生物學層面的多年研究和知識積累,海普瑞以
肝素為基礎,研發新的藥物。而作為全球最大的
肝素原料藥企業,也為自身需求提供了充足的原料。
CDMO業務
海普瑞通過旗下兩家全資子公司——賽灣生物和SPL的CDMO平台共同來經營CDMO業務。2014年,海普瑞完成了對美國最大的肝素鈉原料藥生產商SPL公司的收購;2015年,通過對美國生物大分子藥物開發和生產平台賽灣生物的收購。海普瑞進入大分子CDMO領域。藉助賽灣生物和SPL近半個世紀的經驗積累,海普瑞開發及製造基於創新生物療法的大分子藥品,並支持公司創新管線品種藥物的臨床研發。

海普瑞北美的全資子公司Cytovance
創新藥業務
海普瑞以患者臨床未滿足的需求為始,聚焦差異化創新藥物的投資、開發及商業化,擁有臨床管線。海普瑞持有超過20個同類首創(First-in-class)新藥品種,覆蓋30多種適應症。其中,已有5款藥物開發進入全球III期臨床階段,超過10款藥物開發進入全球II期臨床階段。其中,10個持有大中華區域(包括香港、澳門、台灣)全部權益的品種中,已有3款藥物開發處於全球III期臨床階段。
在研的大中華區權益品種,另外一種由海普瑞發現的專有
腫瘤候選藥物。
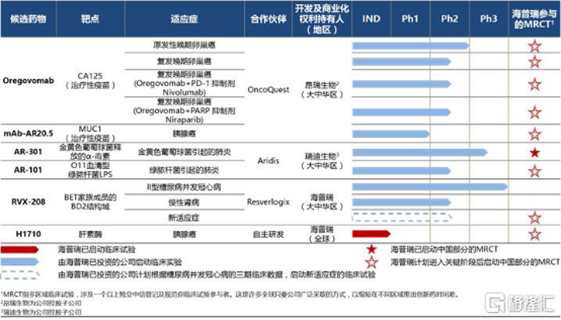
海普瑞在研產品管線
國際多中心臨床試驗
海普瑞在大中華區擁有開發及商業化專有權的候選藥物,計畫於中國開設臨床站點以加入相應的國際
多中心臨床試驗(MRCT),例如Oregovomab及AR-301的3期試驗。其中AR-301試驗已獲國家
藥監局批准。
公司管理
創始人團隊
董監高團隊
管理團隊
社會責任
2021年,深圳市海普瑞藥業集團股份有限公司通過其全資子公司深圳市天道醫藥有限公司(簡稱“天道醫藥”),向深圳市科技評審管理中心無償捐贈一條運行良好的注射劑中試生產線,用於支持深圳市科技評審管理中心孵化、扶持、服務深圳本地生物創新醫藥企業。
2021年,深圳市海普瑞藥業集團股份有限公司通過孫公司天道醫藥向河南省慈善總會捐助現金100萬元,由河南省慈善總會統一調配,用於河南省防汛救災、緊急物資採購以及災後重建工作。
企業榮譽
2001年,海普瑞榮獲國際經濟貿易委員會頒發的“注射級肝素鈉出口基地項目-‘九五’國家技術創新優秀新產品獎”
2002年,海普瑞榮獲國家發展計畫委員會頒發的“國家高技術產業化示範工程”
2007年,榮獲2007-2008年度深圳市民營領軍標桿和骨幹企業
2008年,海普瑞榮獲深圳市人民政府頒發的自主創新行業龍頭企業
2010年,海普瑞榮獲深圳市人民政府、深圳市企業家聯合會、深圳市企業家協會頒發的“深圳特區30周年傑出貢獻企業”。
2011年,榮獲第一批廣東省戰略性新興產業基地
2012年,入選2012年度深圳百強企業
2012年,海普瑞藥業李鋰獲市長獎提名
2013年,入選2013年度“深圳企業百強”
2013年,榮獲深圳市企業聯合會、深圳市企業家協會、深圳市質量協會、深圳市卓越績效管理促進會頒發的“2013首屆深圳質量百強企業”
2013年,榮獲首屆“深圳工業大獎”企業獎
2014年,入選2014年度“深圳百強企業”
2015年,榮登2015年度“最佳海外醫藥投資企業(15強)”企業榜
2016年,榮獲深圳"十佳新銳型全球化公司"
2016年,入選2016年度“深圳百強企業”
2017年,榮獲2017年度“深圳工匠培育示範單位”
2017年,榮獲醫藥經濟報頒發的“2016年中國製藥工業百強”
2018年,榮獲深圳工業總會、深圳工匠評定專家委員會頒發的“深圳工匠培育示範單位”。
2019年,入選2019年度“深圳500強企業”
2020年1月9日,胡潤研究院發布《2019胡潤中國500強民營企業》, 海普瑞藥業集團以市值215億元位列第343位。
2020年3月18日,海普瑞藥業集團以320億元人民幣市值位列《2020胡潤中國百強大健康民營企業》第44。
2020年,入選2020年廣東省專精特新中小企業名單。
2020年,榮獲深圳市質量強市骨幹企業認定工作組委會頒發的“深圳市質量強市骨幹企業”。
2021年,榮獲中國醫藥工業百強排行榜專家委員會頒發的”2020年度中國化藥企業TOP100”。
公司事件
2024年1月14日,海普瑞公告,公司全資子公司Techdow Pharma Italy S.R.L。(“天道義大利”) 近期遭遇犯罪團伙電信詐欺,涉案金額約1170餘萬歐元(約合人民幣9180萬元)。案發後,公司第一時間向當地警方報案,警方已立案並開展案件調查辦理工作。同時公司全力配合警方工作,爭取最大限度避免損失。
2024年1月15日,海普瑞收到深圳證監局監管關注函,監管注意到,公司全資子公司遭遇電信詐欺,涉案金額約1170餘萬歐元。深圳證監局要求公司成立專項工作組,必要時聘請第三方專業機構對該事件進行全面調查,公司應採取一切必要法律手段追回有關資金,切實維護公司資產的安全和完整。
2024年2月2日,深圳市海普瑞藥業集團股份有限公司(海普瑞,002399)發布公告稱,公司於2024年2月2日收到中國證券監督管理委員會深圳監管局出具的《關於對海普瑞藥業集團股份有限公司採取責令改正措施的決定》。
《決定書》指出,經查,公司部分海外子公司在銀行賬戶及網上銀行的日常管理、資金付款的授權及審批、內部資金調撥等方面存在內部控制制度不完善、執行不到位情形。上述情形違反了《上市公司治理準則》(證監會公告〔2018〕29號)第九十四條第一款、《企業內部控制套用指引第6號--資金活動》(財會〔2010〕11號)第四條第一款的規定,反映出公司在規範運作等方面存在問題。根據《上市公司現場檢查規則》(證監會公告〔2022〕21號)第二十一條的規定,我局決定對公司採取責令改正的行政監管措施。
2024年2月3日,海普瑞發布關於深圳證監局對公司採取責令改正措施決定的公告:經查,你公司部分海外子公司在銀行賬戶及網上銀行的日常管理、資金付款的授權及審批、內部資金調撥等方面存在內部控制制度不完善、執行不到位情形。
2024年3月15日,海普瑞晚間公告,公司全資子公司Techdow Pharma Italy S.R.L.(以下簡稱“天道義大利”)遭遇犯罪團伙電信詐欺,涉案金額為1170餘萬歐元。為保障公司及廣大投資者的利益,公司實際控制人李鋰於2月3日承諾,將向公司先行墊付不超過價值1174萬歐元的等值人民幣資金。3月14日,公司收到實際控制人李鋰通過深圳市樂仁科技有限公司先行墊付的款項,合計人民幣8980.96萬元(根據海普瑞2023年12月31日確定營業外損失採用的歐元兌人民幣平均匯率1歐元兌人民幣7.65元,涉案金額1173.98萬歐元計算)。
公告顯示,公司在此確認,如海普瑞或海普瑞的關聯方(包括但不限於天道義大利)通過刑事、民事等法律程式或以其他任何方式向任何相關責任方追回全部或部分款項或獲得任何性質的賠償,在該等款項或賠償追回或獲得後,海普瑞應將該等款項或賠償以固定匯率1歐元兌人民幣7.65元折算而得的等值人民幣返還給深圳市樂仁科技有限公司,上述返還總額不超過深圳市樂仁科技有限公司實際墊付的款項總額,且此墊付款項在墊付期間不產生任何形式的利息。




