簡介,海葵神經毒素,海葵鈉通道毒素,海葵鉀通道毒素,其他通道海葵毒素,海葵毒素空間結構,海葵毒素電生理作用,化學性質,基本性質,檢測,合成,醫學作用,治療心力衰竭,藥物研發,其他作用研究,急救,
簡介 海葵 又名海菊花、海淀根,屬於腔腸動物門Coelenterata、珊瑚蟲綱Anthozoa、六放珊瑚亞綱Hexacorallia。其下有3個目,包括海葵目Actiniaria、群體海葵目Zoanthidea和角海葵目Ceriantharia。海葵種類繁多,有報導的已超過1000種,廣泛分布於世界各海區,中國海葵品種約占世界的1/10。海葵的觸手及身體均含有大量的刺細胞,每個刺細胞里都有一個特殊囊狀的細胞器,名為刺絲囊,內儲存著毒液,刺絲管盤曲在刺絲囊內,刺絲尖端為刺針。當海葵受到外界機械或化學刺激時,會釋放刺絲刺入獵物身體並通過刺絲管將毒素注入獵物體內,以此達到捕食或防禦的目的。
海葵毒素質譜 海葵毒液中富含各種毒素,海葵毒素是
海洋生物毒素 中最毒的毒素,對哺乳動物的心肌具有收縮作用,它和芋螺毒素一樣,已受到高度重視。分子序列中含多對二硫鍵以穩定其結構。對海葵毒素的研究自20世紀70年代開始,已經從約40種海葵中分離到超過300種毒素,根據分子量以及生物學功能的不同,可以分為海葵溶細胞毒素(分子量約20kDa)以及海葵多肽類神經毒素(分子量3~7kDa)兩大類。
海葵神經毒素 海葵神經毒素以鈉離子通道毒素和鉀離子通道毒素為其主要成分,已發現超過70 種,根據其作用靶點的不同可以分為三大類,分別為作用於電壓門控鈉離子通道(Nav)的毒素,分子量為3~5kDa;作用於電壓門控鉀離子通道(Kv)的毒素,分子量為3.5~6.5kDa;以及作用於其他離子通道的多肽毒素;此外,還有部分海葵多肽類神經毒素能特異地作用於甲殼動物,但尚不清楚其具體分子靶標。
海葵鈉通道毒素 電壓門控鈉通道廣泛存在於動物的神經系統、心臟、肌肉、神經膠質等組織的細胞中。到為此,通過分子克隆的方法已經在哺乳動物(包括人和鼠)體內分離鑑定到了一系列的鈉通道亞型,分別被命名為Nav1.1~Nav1.9[1]。在對鈉通道的研究過程中,來自各種生物的鈉通道毒素分子作為工具試劑極大地推動了對鈉離子通道結構與功能的認識。
海葵鈉通道毒素胺基酸序列 海葵鈉通道毒素是在20世紀70年代從海葵中分離到的一類多肽毒素分子,通過分離純化以及基因克隆的方法從海葵中分離到總計超過50種鈉通道毒素,Norton 等根據其胺基酸序列差異將其分為三種類型,分別為1型,2型和3型(圖1)。1型和2型鈉通道毒素通常由46-49個
胺基酸 殘基組成,分子中均含6個半胱氨酸並形成三對二硫鍵,連線方式為I- V,II- IV和III- VI。已發現有超過30種海葵鈉通道毒素屬於1型,而在屬於2型鈉通道毒素中僅發現不到10種。這兩型鈉通道毒素的半胱氨酸殘基在序列中分布具有保守性,但其一級結構方面又各有特點,例如,1型鈉通道毒素序列中帶電荷胺基酸數量較少,而2型鈉通道毒素則含有豐富的帶電荷胺基酸殘基,此外2型鈉通道毒素的帶電荷殘基在其序列中呈簇狀分布,例如在其N端存在有連續的- Asp- Asp- Asp/Glu- 序列,在其序列C端存在- Arg- Lys- Lys- Lys-序列。而1型鈉通道毒素則沒有這一結構特徵。
儘管1型和2型鈉通道毒素在序列上存在較大差異,但普遍認為這兩型鈉通道毒素起源於一個共同的祖先分子,同時,ISHIDA 等從最原始的一類海葵Halcurias sp中分離到一種名為Halcurin的鈉通道毒素,Halcurin的序列同時具有1型和2型鈉通道毒素的結構特徵,因而更加證實了1型和2型鈉通道毒素具有共同祖先的假說。此外,1型和2型鈉通道毒素的分布具有種屬特異性,例如,在海葵Actiniidae 中發現僅存在1型鈉通道毒素,而在列指海葵科Stichodactylidae中則既有1型也有2型鈉通道毒素。
3型鈉通道毒素是一類相對較短的多肽毒素,只發現5種,通常由27~32個胺基酸殘基組成,分子中含8個半胱氨酸並形成四對二硫鍵,但也有例外,如MARTINEZ 等從溝迎風海葵Anemonia sulcata中分離到的ATX III只含三對二硫鍵。與1型及2型鈉通道毒素相比,3型鈉通道毒素不僅二硫鍵的數量要多,同時其半胱氨酸在序列中的分布也有很大不同,例如,1型和2型鈉通道毒素的雙聯半胱氨酸(- Cys-Cys-)位於序列的C 端,而3型鈉通道毒素的- Cys- Cys- 位於序列的N 端,這也預示著3型鈉通道毒素可能採取了一種完全不同於1型及2型鈉通道毒素的結構模體。
動植物中存在許多天然鈉通道毒素,而在哺乳動物神經元鈉通道上已發現了六個部位能夠與上百種毒素相結合。這些位點分布於細胞膜外側、通道孔內側和跨膜段上。CESTLE等將這些電壓門控鈉通道的不同部位依次命名為位點1~位點6(site1~site6),而分別結合於這些位點的毒素則相應稱之為位點1毒素~位點6 毒素。研究表明,海葵1型,2型和3型鈉通道毒素的作用靶點均為鈉通道的位點3,作用方式為抑制鈉通道的失活而使鈉通道保持在開放狀態,從而使得動作電位重複發放,造成獵物出現痙攣。海葵鈉通道毒素的這一作用模式與來自蠍的毒素極為相似,但兩者在胺基酸序列以及空間結構方面均無相似性,因而引起了人們的極大興趣。海葵鈉通道毒素以其高特異性,強的親和能力而成為研究鈉離子通道結構與功能極好的工具試劑,例如,來自溝迎風海葵的毒素ATX II 以及來自黃海葵Anthopleura xanthogrammica的ApA和ApB毒素多肽均為研究鈉通道的常用工具試劑。
隨著研究的深入,越來越多的海葵鈉通道毒素被發現,特別是一些具有新型結構特點的毒素被分離,例如從寄生美麗海葵Calliactis parasitica中分離到的新型鈉通道毒素calitoxins I和II,這兩種毒素儘管其二硫鍵數目及半胱氨酸殘基在序列中的分布類似於1型及2型鈉通道毒素,但其序列差異較大,因而是一種不同於上述1型,2 型和3型的新型鈉通道毒素。
海葵鉀通道毒素 鉀離子通道在所有可興奮性和非興奮性細胞的信號傳導過程中具有重要作用,其家族成員在調節神經遞質釋放、心率、胰島素分泌、神經細胞分泌、上皮細胞電傳導、骨骼肌收縮、細胞容積等方面發揮重要作用。按其特性,鉀離子通道可分為三大類:外向延遲整流鉀通道(Kv),鈣激活鉀通道(KCa),以及內向整流鉀通道(Kir)。其中外向延遲整流鉀通道(Kv)是最為豐富的一類,其成員包括從Kv1到Kv12 等,是眾多動物毒素的作用靶標之一,其中,作用於Kv1(shaker- related K+channels)的毒素主要來自蠍,海葵,蜂類,以及蛇毒;作用於Kv3(shaw- related K+channels)的主要有海葵毒素;而蜘蛛毒素中發現的鉀離子通道抑制劑主要作用在Kv2(shab- related K+channels)和Kv4(shal-related K+channels)兩種鉀離子通道。
海葵鉀通道毒素最早發現於1995年,已有十多種海葵鉀通道毒素被分離到,根據其一級結構的不同可將其分為三類,分別為1型,2 型和3型。1型鉀通道毒素主要包括來自列指海葵Stichodactyla helianthus的ShK,來自溝迎風海葵的AsKS,來自海葵Bunodosomagranulifera的BgK,來自公主海葵Heteractis magnifica的HmK,和來自Actinia equina的AeK等。
海葵鉀通道毒素胺基酸序列 1型鉀通道毒素由35-37個胺基酸殘基組成,序列中含六個半胱氨酸並形成3對二硫鍵,其連線方式不同於海葵鈉通道毒素,為I- VI,II- IV 和III- V。海葵1型鉀通道毒素主要作用於Kv1鉀通道並阻斷鉀離子電流,且對Kv1鉀通道的阻斷作用非常強烈,例如,ShK 對Kv1.1和Kv1.3 鉀通道的半抑制濃度(IC50)達皮摩爾水平,是發現的活性最強的Kv1鉀通道毒素之一,這對於Kv1鉀通道及其相關疾病的研究具有重要意義。此外,ShK還被發現能強烈抑制Kv3.2鉀通道電流,其IC50為0.6 nM。
海葵2型鉀通道毒素髮現得還不多,僅SCHWEITZ 等人從溝迎風海葵中分離到三種鉀通道毒素,命名為AsKC- 1,2和3,這三種毒素多肽由58~59個胺基酸殘基組成,序列中含六個半胱氨酸,形成三對二硫鍵。AsKC- 1~3 對Kv1鉀通道的抑制活性較1型鉀通道毒素要弱很多,此外,AsKC-1~3還具有蛋白酶抑制劑的功能,是一種雙功能分子。從序列上來看,AsKC-1~與來自牛胰的kuniz型蛋白酶抑制劑BPTI以及來自蝰蛇的Kvx鉀通道毒素Dendrotoxins 均具有較高的序列相似性,因此AsKC1~3具有兩種完全不同的功能並不另人意外,儘管BPTI與Dendrotoxins在序列上也有很高的相似性,但兩者並不具備對方的生物學功能。kuniz 型蛋白酶抑制劑在動物毒素中被多次報導,如在蛇,蜂,海葵等毒素中均有發現,該蛋白酶抑制劑能防止毒素在獵物體內被獵物本身的蛋白酶所降解,延長毒素多肽在獵物體內的半衰期,因而在有毒動物的捕食和防禦過程中具有重要的意義。同時具有鉀通道抑制活性和蛋白酶抑制活性的雙功能毒素分子報導還不多,對這類雙功能分子在進化上的地位及其演化過程尚無定論。
海葵3型鉀通道素主要發現3種,分別是來自海葵Anemonia sulcata 的由43個胺基酸殘基組成的BDS-I和BDS- II[18],以及來自海葵Anthopleura elegantissima 的由42 個胺基酸殘基組成的APETx1[。BDS-I和BDS- II能特異的抑制Kv3.4通道。APETx1能選擇性地抑制人erg1基因(human ether- a-go- go- related gene,HERG)編碼的快速延遲性整流性鉀通道電流;Kv3.4鉀通道主要存在於基底神經中樞外部的神經元亞群中,與帕金森氏症有密切關係。而HERG 鉀通道在心臟起搏細胞電流頻率的調節及維持心肌細胞靜息電位的穩定性中起著重要作用,與長程Q-T綜合症密切相關,BDS- I,II以及APETx1由於對上述鉀通道的專一性抑制作用而使得這類毒素有望開發成治療上述疾病的藥物先導分子。
其他通道海葵毒素 DIOCHOT等從海葵Anthopleura elegantissima中分離到了一種長度為42個胺基酸的多肽類毒素APETx2。儘管它與APETx1具有64%的序列相似性性。但是,APETx2 對鉀通道沒有活性,它主要作用於感覺神經元上的酸敏感型離子通道(acid- sensitive- ion- channels,ASICs)。ASICs與痛覺編碼有關,是一種由六個亞基組成的同聚或異聚體,APETx2能特異地與含ASIC3亞基的ASICs結合,從而影響ASICs的功能。由56個胺基酸殘基組成,該毒素可特異的作用於1型瞬時感受器電位離子通道(transient receptor potential vanilloid type 1,TRPV1),該型離子通道又稱為辣椒素受體門控離子通道,在疼痛的傳導中起到重要作用。
從海葵中還發現不少多肽毒素對甲殼類動物具有特異的致死或麻痹作用,而對哺乳動物沒有活性,該類多肽毒素的作用靶點尚不清楚,但其對甲殼動物所表現出的選擇性毒理作用使其有望成為開發殺蟲肽的先導分子。例如,來自海葵Anemonia erythraea的AETX II和III,來自海葵Stichodactyla gigantea 的gigantoxin I,以及來自海葵Antheopsis maculate的Am I和II等。其中,AETX II和III由59個胺基酸殘基組成,序列中含10 個半胱氨酸。
海葵神經毒素胺基酸序列 海葵毒素空間結構 對毒素的結構研究有助於了解毒素與其靶標相互作用的機制,是了解毒素結構與功能的關係的基礎。在蛋白質結構資料庫中已有超過300種毒素的空間結構發表,其中大部分來自蛇,蠍,蜘蛛及芋螺等動物的毒素,來自海葵的多肽毒素的空間結構有12種,其中,海葵鈉通道毒素7種,海葵鉀通道毒素4種,其他離子通道毒素1種,全部為核磁共振(nuclear magnetic resonance,NMR)的方法所解析。海葵多肽毒素的結構與功能的關係相當複雜,對海葵毒素的結構及藥理學功能的研究不僅能使人們深入了解海葵多肽毒素的結構與功能的關係,同時也為從海葵毒素中開發極具意義的藥理學試劑奠定了基礎。
海葵多肽毒素空間結構 海葵鈉通道毒素中第一種解析空間結構的是來自海葵Anemonia sulcata的ATX- I,1989 年,WIDMER等研究了ATX-I的溶液三維結構[43],ATX-I由46個胺基酸殘基組成,其空間結構主要包括4 鏈反平行摺疊片(sheet)以及三個環(Loop)結構,其中一個環較長,由11個胺基酸(8-19)殘基組成並具有較大的柔性,整個結構由三對二硫鍵連線並得以穩定;之後來自同一海葵的另一種鈉通道毒素ATX- III 的空間結構被解析,ATX- III 由27 個胺基酸殘基組成,其結構主要包括四段回折(turn),分別為殘基6-9、8- 11、12-14和15-17,沒有規則的二級結構如螺旋和摺疊等;來自黃海葵Anthopleura xanthogrammica 的著名鈉通道毒素ApA和ApB的結構於1995年被解析,兩者採取了相似的結構模體。
ApA由49個胺基酸殘基組成,其結構主要包括四鏈反平行,分別由殘基2- 4,20- 23,34- 37 和45- 48 組成,其間由三段Loop 連線,第一個Loop 環較長且具有很強的柔性,位於這一Loop 中的殘基Asp7,Asp9 以及第三個Loop 附近的His39 一起構成ApA 的活性位點,在ApA 與哺乳動物心肌鈉通道的結合過程中發揮著關鍵作用;ApB 的結構中同樣包含四鏈反平行"- 摺疊(殘基2- 4,20-23,34- 37 和45- 48)以及三段Loop,其中第一個Loop 類似於ApA 和ATX- I,由10個胺基酸殘基組成(殘基8- 17),具有較強的柔性,同樣被認為是其活性位點所在區。
海葵毒素電泳圖譜 海葵毒素電生理作用 海葵毒素的特性之一是與鈉通道的結合呈電壓依賴性,即與鈉通道的親和力在膜去極化時降低。ATXⅡ可延長多種動物包括大鼠,豚鼠和牛心肌細胞動作電位時程(APD),增強豚鼠心室乳頭狀肌收縮力,對豚鼠和大鼠單個心室肌細胞動作電位(AP)也引起APD延長和收縮力增強。在20~30nmol/L使豚鼠心室乳頭狀肌APD延長一倍,而不改變0相最大去極速率(Vmax)和靜息膜電位,40nmol/L延長APD,引起早後除極(EAD)。在豚鼠心室肌細胞ATXⅡ20nmol/L引起一淨內向緩慢失活的鈉電流,在8.4秒的長時間去極化過程中不能完全失活,此電流可被60μmol/L TTX完全阻斷。單通道研究發現1μmol/L ATXⅡ使兔心室肌鈉通道長時間開放,且這種作用呈電壓依賴性,在較正膜電位時作用更明顯,ATXⅡ主要影響鈉通道從開放態到失活態的轉換速率,而不影響通道其他狀態間轉換的速率。認為其延長APD系通過抑制鈉通道的失活,引起Na+大量內流所致。另外,在豚鼠和牛心室肌細胞,ATXⅡ能抑制內向整流鉀電流(IK1),這也是延長APD的原因。ATXⅡ使大鼠心室肌動作電位平台期延長並壓低,是由於細胞內鈉活性(aiNa)升高,鈉泵活動及Na+/Ca2+交換所致細胞內Ca2+增加,在較負的膜電位時Na+/Ca2+交換產生和增加內向電流,因生電性Na+/Ca2+交換方向與膜電位有關,在靜息電位時,產生淨內向電流,在平台期電位時則相反。
海葵毒素對鈉通道影響 ATXⅡ延長APD的作用呈頻率依賴性,在低頻率延長更明顯,這是由於低頻率刺激下,復極時外向鉀電流較小,內向電流的輕微增加即可有效地延遲復極,而高頻率刺激下,動作電位產生在前次復極鉀電流未完全失活的基礎上,重複刺激時,外向電流增大,故APD的延長較少。鈉通道失活延遲有重要的生理和病理意義,APD延長可引起平台期膜電位震盪,致EAD,而引起致死性室性心動過速等。APD延長使鈣通道開放時間延長,鈣內流增加,導致心肌收縮力增強,另Na+進入細胞的量增多,aiNa升高,通過Na+/Ca2+交換引起胞內Ca2+增多也是其正性肌力作用的另一原因。也有人認為ATXⅡ通過增加aiNa而使胞內Ca2+增多的機制是由於Na+和Ca2+在細胞內競爭一共同載體的結合位點而使Ca2+外向運輸減少,並從而增加Ca2+釋放。還有人認為鈉泵運轉的增加利於Ca2+與質膜磷脂結合,使細胞興奮時更多的Ca2+從此位點釋放。在脊椎動物骨骼肌細胞,ATXⅡ延遲鈉通道失活過程,延長APD,增大終板電位,致骨骼肌去極化,使鈉電流變為類似於肌強直患者中觀察到的持續內向電流,因此可用於製作此病理模型。在分離的大鼠新皮層錐體神經元,ATXⅡ可選擇性地阻滯INa快速失活,增加去極化時持續鈉內流,從而增強神經元放電,而不影響鈣電流和鉀電流。Site-3毒素還可與作用於鈉通道其他部位的毒素髮生相互作用,TTX和利多卡因在不影響Vmax的濃度下縮短由ATXⅡ延長的APD,減小ATXⅡ引起的緩慢失活的內向電流。同類中還有ATXⅢ和ATXⅣ,其作用與ATXⅡ相似。ATXⅢ由27個胺基酸殘基組成,ATXⅣ是ATXⅢ的衍生物,與ATXⅢ不同之處僅在於其C-末端缺少兩個胺基酸殘基(lys-val),二者均減慢蟲剌蛄巨大神經軸突鈉通道失活過程,而對其激活無影響。
海葵毒素對大鼠心室鉀電流作用 Kalicludines和Kaliseptines也是從海葵Anemonia sulcata中分離出多肽,前者由58~59個胺基酸殘基組成,後者由36個胺基酸殘基組成,二者是電壓敏感性鉀通道的阻斷劑,Kalicludines結構與Dendrotoxins有同源性,表現出與後者相同的阻斷電壓敏感性鉀通道的作用。Kaliseptines與Dendrotoxins無序列同源性,但它與Kalicludines一樣是一強效的鉀通道阻斷劑。
毒素對鈉通道神經電流影響 從海葵Anemonia sulcata中分離出來的BDSⅠ及BDSⅡ是含43個胺基酸殘基的多肽,二者序列僅有兩個位點不同,它們與從其他海葵中提取的鉀通道毒素如BgK,ShK,AsKs,AsKc等無序列同源性,BDSⅠ可逆地抑制Kv3.4電流,而對Kv1、Kv2、Kv3和Kv4亞家族中的其他鉀通道無作用。BDSⅡ與BDSⅠ結合部位相同,二者是迄今最早鑑定的迅速失活的Kv3.4通道的特異阻斷劑。它們和一些鈉通道毒素如ASⅠ、ASⅡ和AXⅠ等有某些序列同源性,BDSⅠ對鈉通道作用很弱或無作用,1μmol/L濃度並不影響電壓依賴性鈣通道。BDSⅡ還是電壓依賴性鈉通道site-3位點的拮抗劑,抑制豚鼠心房肌收縮力。
化學性質 基本性質 海葵毒素一級結構來看,大部分為46-49個胺基酸,稱為長鏈神經毒素,分子量在7kDa左右;另一些分子量小於3kDa的多肽,稱為短鏈
多肽 毒素。這種毒素皆由46-49個胺基酸殘基組成;存在6個Cys殘基;所有毒素存在12個相同的胺基酸殘基(包括6個cys);所有的毒素c末端都是親水性胺基酸殘基;至今發現的所有海葵毒素都存在三對二硫鍵。由於相同的蛋白活性應該具有相似的結構特徵。以上5個特性構成了海葵毒素的共性,這是表現生理活性的基本要素。
海葵毒素紫外光譜 海葵毒素屬聚醚類化合物,同樣含有高度氧化的碳鏈,但僅部分
羥基 形成
醚 環,多數羥基呈游離狀態,屬於水溶性聚醚。其中代表毒素岩沙海葵毒素是日本的上村大埔和美國的Moor兩個小組同時從岩沙海葵(Palythoa toxicus)中分離得到的毒性成分,它的毒性也極為強烈,LD50為0.15μg/kg,比
河豚毒素 高一個數量級,是非蛋白毒素中最毒的物質之一。它的分子量達2677,分子式為C129H221O54N3,是一個複雜的長鏈
聚醚 化合物,花了10年時間才於1981年底完成了其分子結構的測定,是光譜技術和化學方法相結合在結構鑑定中的一個經典例證。
PTX是最強的冠脈收縮劑,作用強度比血管緊張素強100倍。研究表明PTX具有顯著的抗腫瘤活性,當注射劑量為0.84 ng/kg時,能抑制艾氏腹水瘤細胞的生長,增加劑量,不但可使瘤體消失,而且可使動物存活下來。海葵毒素還是一種新型的溶細胞素。1995年安元健又從渦鞭毛藻分得五個海葵毒素類似物。海葵毒素含有64個手性碳和7個雙鍵,共有271個立體異構體。
玫瑰海葵質譜 檢測 檢測多採用小白鼠生物測定法、
氣相色譜 (GC)法、
高效液相色譜 (HPLC)法以及新發展的GC/MS(
質譜 分析)和HPLC/MS等方法。但小白鼠生物測定法所需周期長、HPLC和GC方法對設備要求較高,操作較繁,價格昂貴。對供試品需要進行純化預處理,不能快速進行大批量供試品的分析。ELISA檢測方法用於檢測PTX,具有靈敏、快速、特異性強等優點。
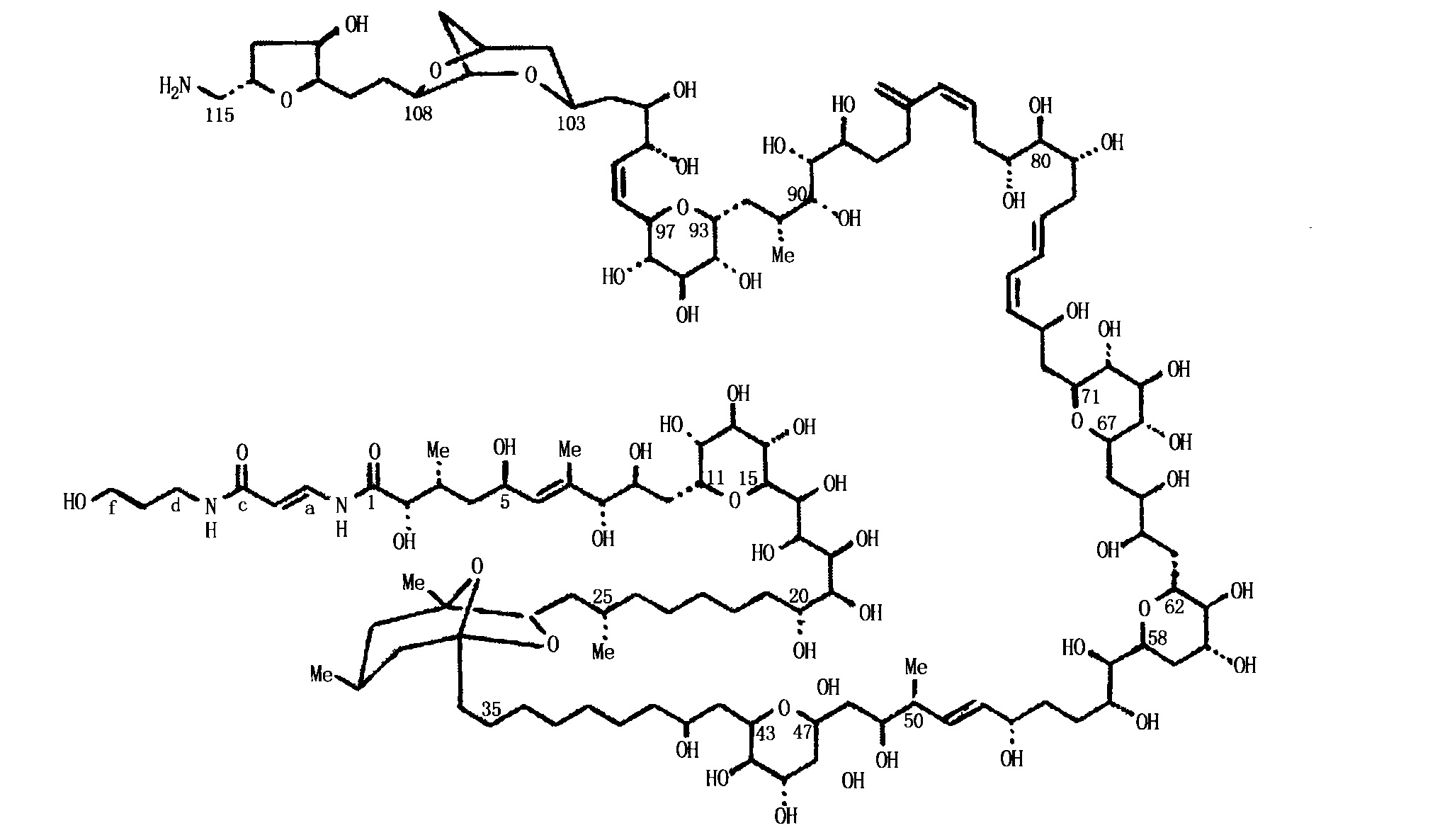
海葵毒素檢測限 合成 海葵毒素用等離子解吸質譜法(PDMS)測出分子量為2681.1±0.15,分子式為C129H223N3O54,具有64個不對稱中心。其結構確定主要通過:NaIO4氧化,使分子在鄰羥基位置切為多個片段;臭氧化,將分子的雙鍵位置切斷,得到多個結構片段。確定片段的化學結構後,批接反推出化學結構。在全合成之前,進行了較完整的立體化學研究。
完成海葵毒素全合成的是哈佛大學的Kishi等,該化合物的結構確定過程為全合成奠定了基礎。他主要是通過合成8個關鍵結構片段(C1-C7,C8-C22,C23-C37,C38-C51,C52-C75,C76-C84,C85-C98,C99-C115),這些片段又通過立體選擇性引入雙鍵對接,而得到海葵毒素整個分子。合成這樣龐大且手性中心眾多的分子,引入
雙鍵 對接分子片段是關鍵,各分子片段中的保護基團十分重要。全保護海葵毒素羧酸帶有8種42個保護基,通過不同方式脫去保護基團後,再完成最後合成。全程歷經14年的努力,該化合物是全合成的分子量最大,手性碳最多的一個化合物。工程之艱巨,可想而知。這個合成堪稱攀登有機合成化學界的珠穆朗瑪峰。
醫學作用 海葵神經毒素能專一性作用於可興奮細胞膜電壓依賴性離子通道,延長了肌肉的動作電位時程,延緩了鈉離子通道的失活,從而增加了鈉離子內流,使細胞內鈉離子的濃度增高,並進一步通過Na+/Ca2+離子交換機制和繼發的鈣通道開放刺激內鈣釋放,導致細胞內的鈣離子濃度增加,起到增強心肌收縮的作用。因此,人們利用海葵神經毒素的強心活性,廣泛開展治療心血管疾病相關藥物的研究。
治療心力衰竭 AP-A和AP-B具有增強心肌收縮的作用,其藥效大大強於G毒毛旋花苷,被認為是治療心衰的極有潛力的藥物,AP類強心多肽正開發用於充血性心力衰竭和肌無力的治療。中國利用RT-PCR方法,從海葵Anthopleura sp觸手總RNA中分離出多個胺基酸序列與海葵神經毒素Ap-C高度相似的神經毒素新基因。重組海葵神經毒素rHk2a在慢性充血性心力衰竭(CCHF)紐西蘭白兔左心室模型和犬的急性心功能不全動物模型上進行研究,實驗結果表明Hk2a能夠在給藥後即刻明顯增加試驗兔、犬的左心室射血分數,作用時間持續60分鐘以上,與西地蘭治療相比具有起效快、作用強等特點。另外,在毒理學方面,試驗也證實了Hk2a在CCHF紐西蘭兔中以20μg/kg劑量注射是安全的,且反覆注射Hk2a並沒有出現過敏反應。而當Hk2a的套用劑量超過50ug/kg時可引起室性心率失常,包括頻發性室性早搏,短陣性心動過速和心室顫動。說明重組海葵毒素rHk2a在臨床治療心力衰竭方面很有潛力。
藥物研發 抗心律失常藥物mexiletine (Mex)在臨床上可用於治療肌強直,Desaphy JF等通過在mexiletine的手性碳原子上用異丙基取代甲基而開發出新的化合物Me5,後利用鼠骨骼肌纖維建立肌強直的Na+通道藥理模型,並加入海葵毒素ATX II延滯其Na+流速,使該Na+通道藥理模型具有更好的可控性及觀測性質。從而說明Me5能更有效地阻礙細胞內鈉離子的流動,可以將其開發成預防心律失常的藥物。
其他作用研究 Kazuo Shiomia等人從海葵Stichodactylagigantea中分離出gigantoxin I與哺乳動物的表皮生長因子(EGFs)有31% ~33%的同源性,在胺基酸結構對等位置上具有相同的6個胱氨酸殘基,通過融入A431細胞及EGF受體上的酪氨酸磷酸化激活實驗證明gigantoxin I具有EGF活性,雖然其效能低於人EGF因子。
海葵毒素對心肌電位影響 有人根據蛋白基因序列對比研究說明,昆蟲Na+通道的主要結構與哺乳動物相同,海葵神經毒素也能選擇性作用於昆蟲的電位門控Na+通道,可作為具有殺蟲劑效果的“先導化合物”。而海葵神經毒素基因工程產物的可生產化和昆蟲敏感型毒性機理的研究開展,為開發低毒、環保的蛋白類殺蟲劑提供了理論基礎和可行性依據。
急救 海葵毒素主要為血液毒,該毒素具有強烈的縮血管作用,臨床表現類似心絞痛症狀。另外,它還具有腎毒性、破壞肌細胞、溶血、影響胃腸道等作用,若救治不及時,可致死亡。(2)急救處理是治療的關鍵。受傷當時可用海水浸泡(用淡水無效)。入院後,儘早行局部切開排毒並以溫熱高濃度鹽水反覆沖洗切口中和毒素,同時應儘量刮除扎入體內的觸手和刺絲囊;用5%醋酸或40%~70%異丙醇、飽和明礬溶液、氯化銨溶液等均可阻止刺絲囊進一步發射刺絲併兼有中和毒素的作用;而活性氯(5.25%的漂白粉溶於1 mmol/L鹽酸溶液)、0.5~1.0 mol/L NaOH溶液是海葵皮膚染毒的有效消毒劑。出現神經精神症狀時可用阿托品皮下注射、維生素B2肌肉注射。(3)中和毒素,阻止毒素的進一步吸收是防止病情加重的必要措施。罌粟鹼和消心痛對抗海葵毒素有顯著療效。(4)後期併發症的處理是保證救治成功的重要環節。如出現心律失常可用異搏定;局部疼痛可用嗎啡、杜冷丁等止痛藥物;預防和治療感染;出現低蛋白血症,及時輸入白蛋白、少量多次輸血;保護腎功能、防止腎衰等都是治療過程中不可忽視的問題。(5)重視局部的處理。經早期處理後,局部創面保持乾燥、無菌。皮炎嚴重或傷口癒合緩慢者則需要清創、換藥。壞死範圍較大、不能自行癒合者,可行植皮或皮瓣轉移。
 海葵毒素質譜
海葵毒素質譜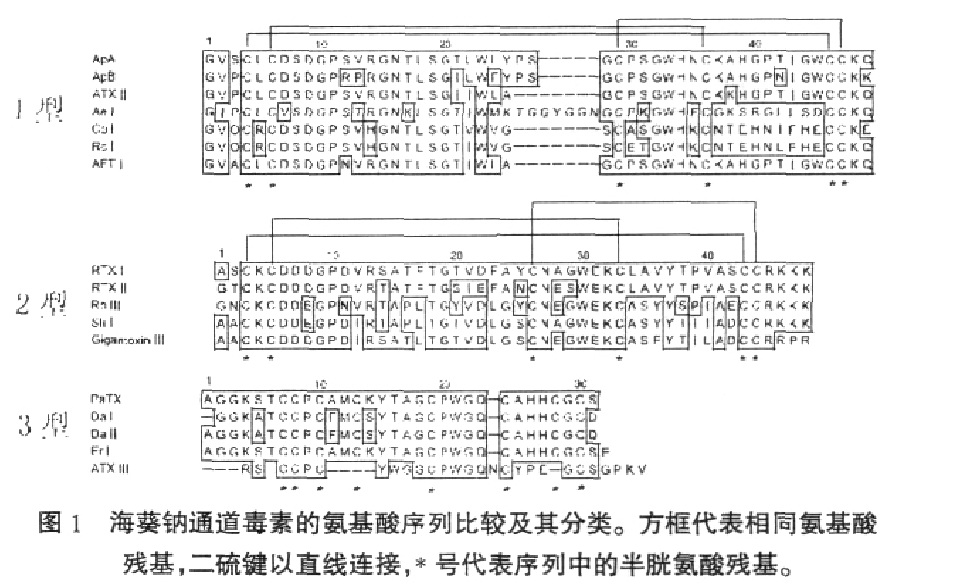 海葵鈉通道毒素胺基酸序列
海葵鈉通道毒素胺基酸序列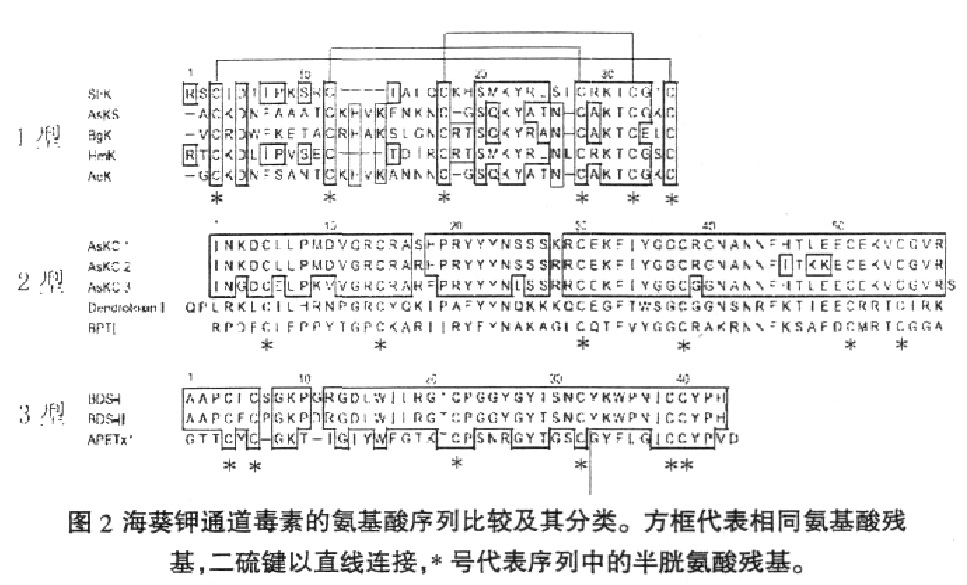 海葵鉀通道毒素胺基酸序列
海葵鉀通道毒素胺基酸序列 海葵神經毒素胺基酸序列
海葵神經毒素胺基酸序列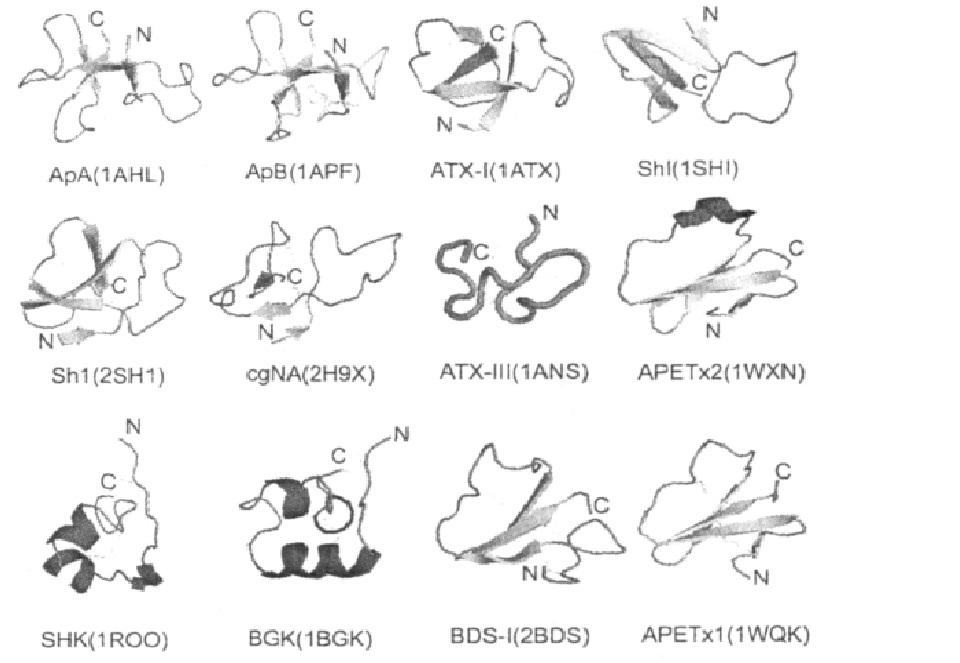 海葵多肽毒素空間結構
海葵多肽毒素空間結構 海葵毒素電泳圖譜
海葵毒素電泳圖譜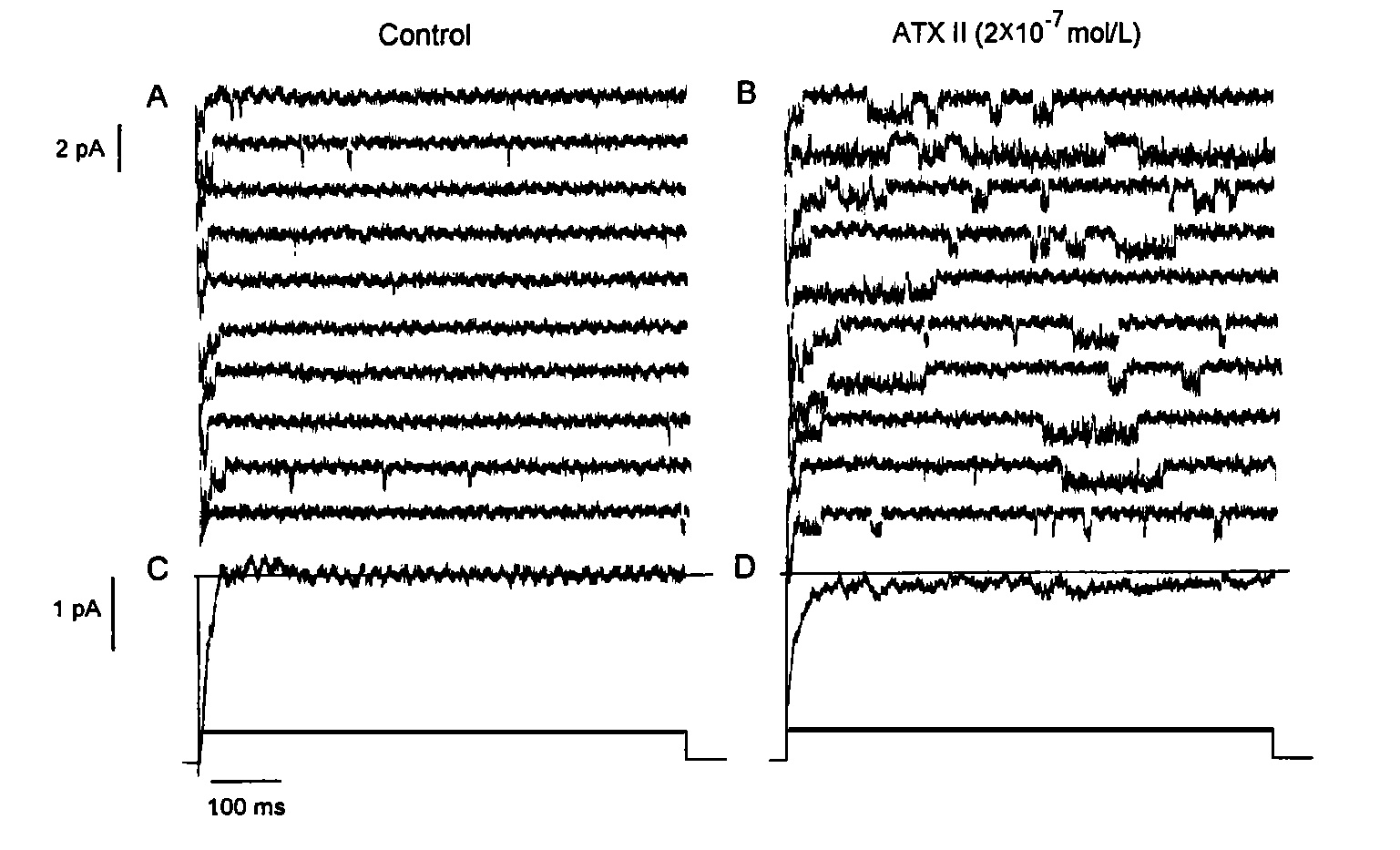 海葵毒素對鈉通道影響
海葵毒素對鈉通道影響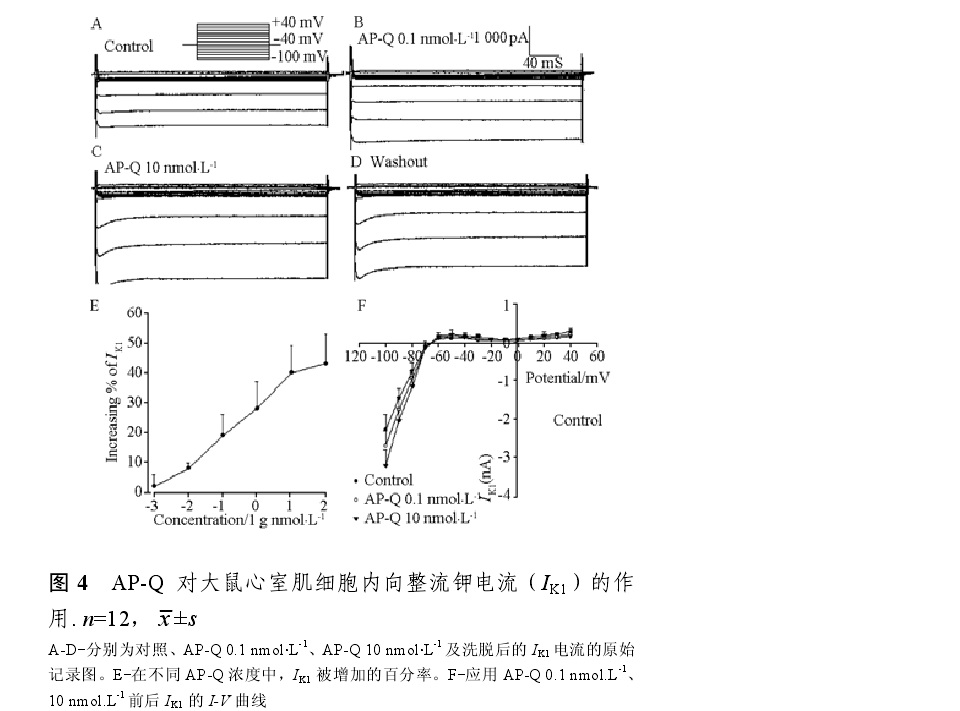 海葵毒素對大鼠心室鉀電流作用
海葵毒素對大鼠心室鉀電流作用 毒素對鈉通道神經電流影響
毒素對鈉通道神經電流影響 海葵毒素紫外光譜
海葵毒素紫外光譜 玫瑰海葵質譜
玫瑰海葵質譜 海葵毒素檢測限
海葵毒素檢測限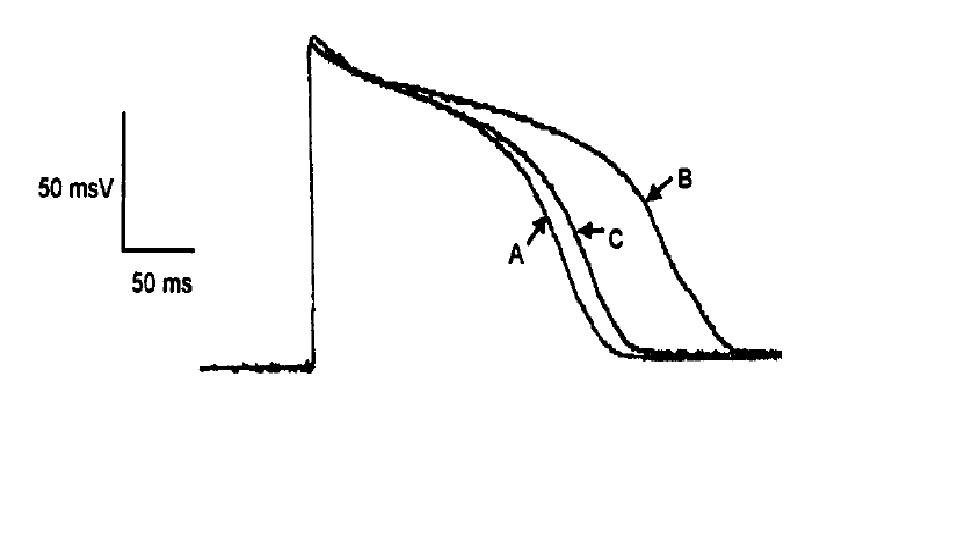 海葵毒素對心肌電位影響
海葵毒素對心肌電位影響