由海特勒和倫敦給出的關於多粒子體系能量計算的一種近似方法。其要點是:在給出體系的哈密頓算符之後,選擇體系的恰當的近似波函式,然後用求平均值的公式計算出體系的能量。
基本介紹
- 中文名:海特勒-倫敦近似法
- 外文名:Heitler London approximation
- 套用學科:量子力學術語
- 範疇:數理科學
- 涉及:哈密頓算符
- 定義:多粒子體系能量計算的一種近似法
技術簡介,海特勒-倫敦近似法處理氫分子,
技術簡介
由海特勒和倫敦給出的關於多粒子體系能量計算的一種近似方法。其要點是:在給出體系的哈密頓算符之後,選擇體系的恰當的近似波函式,然後用求平均值的公式計算出體系的能量。
1927年德國物理學家W.H.海特勒和F.W.倫敦首次完成了氫分子中電子對鍵的量子力學近似處理,這是近代價鍵理論的基礎。
海特勒-倫敦近似法處理氫分子
氫分子的哈密頓算符是:

式中 、
、 為核
為核 、
、 與電子
與電子 之間的距離;
之間的距離; 為兩個電子之間的距離;
為兩個電子之間的距離; 為兩個原子核之間的距離(圖1);
為兩個原子核之間的距離(圖1);







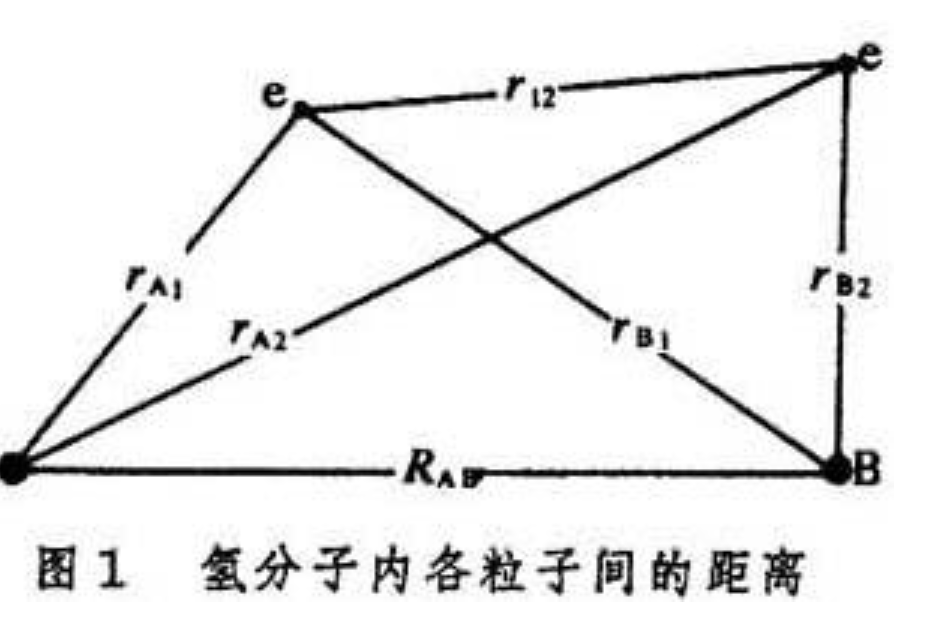
圖1 氫分子內個粒子間的距離








海特勒-倫敦方法的要點在於如何恰當地選取基態 的近似波函式
的近似波函式 (或稱嘗試波函式),然後用變分公式使氫分子能量
(或稱嘗試波函式),然後用變分公式使氫分子能量 為最低(假定
為最低(假定 是歸一化的):
是歸一化的):






































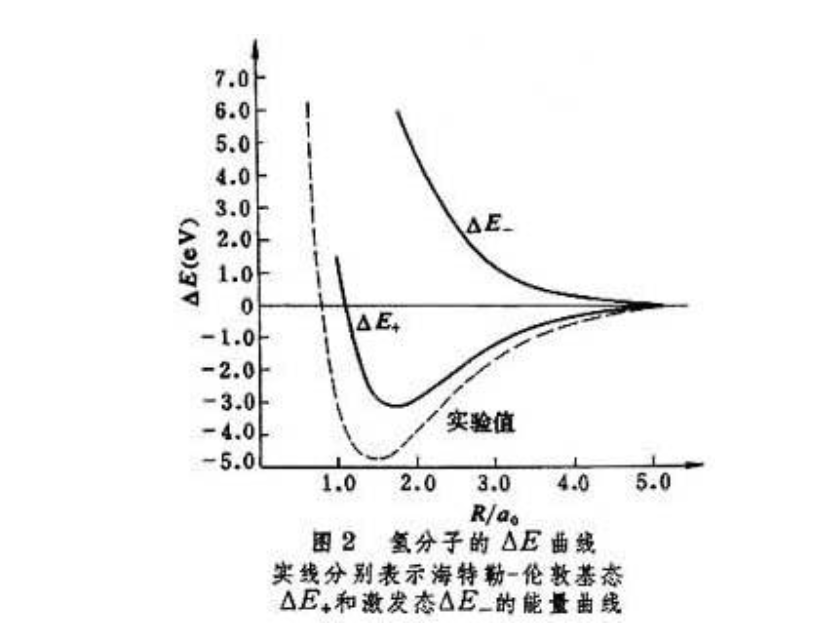
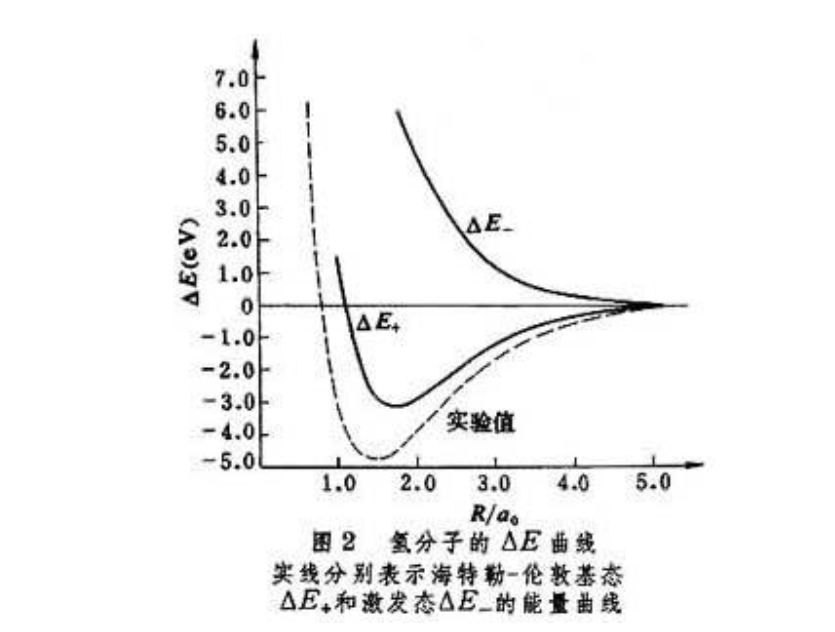
圖2 氫分子的E曲線