注射用奧加伊妥珠單抗是全球首個經批准治療R/R B-ALL的抗體偶聯藥物(ADC)。注射用奧加伊妥珠單抗於2021年12月20日獲得中國國家藥品監督管理局批准,並於2022年6月19日正式全國上市。
基本介紹
- 藥品名稱:注射用奧加伊妥珠單抗
- 外文名:Inotuzumab Ozogamicin for Injection
- 別名:貝博薩
- 主要適用症:用於復發性或難治性前體B細胞急性淋巴細胞性白血病(R/R B-ALL)成年患者
- 劑型:注射劑
- 批准文號:國藥準字SJ20210033
藥品數據,專家解讀,發展歷程,成份,性狀,適應症,規格,用法用量,禁忌,臨床試驗,貯藏,包裝,有效期,執行標準,批准文號,生產企業,
藥品數據
INO-VATE ALL研究的Ⅲ期臨床試驗結果,326例ALL患者分別接受Inotuzumab ozogamicin和標準化療,結果Inotuzumab ozogamicin組PFS和OS分別為5個月和7.7個月,化療組分別為1.8個月和6.7個月,OS優勢未達統計學顯著性。完全緩解率Inotuzumab ozogamicin組顯著高於化療組(81% vs. 29%)。
專家解讀
中國醫學科學院血液病醫院副所院長王建祥教授表示,大部分患者在達到完全緩解後還會面臨疾病復發,R/R B-ALL治療領域目前仍存在著尚未滿足的臨床需求,亟需新的治療方案。貝博薩的上市,打破了成年R/R B-ALL患者的臨床治療困局,填補了治療空白。
哈爾濱血液病腫瘤研究所所長馬軍教授表示,通過進行造血幹細胞移植實現R/R ALL治癒是中外診療指南一致推薦的治療方案。作為急性白血病首個獲批上市的ADC藥物,與標準化療相比,有望幫助更多患者後續有機會進行造血幹細胞移植,進而達到長期生存的目的。
發展歷程
貝博薩(注射用奧加伊妥珠單抗)於2015年10月被美國食品與藥物監督管理局(FDA)授予在ALL治療上的“突破性治療”資格,2017年在歐盟和美國獲批,用於治療R/R B-ALL。於2021年12月20日正式獲得中國國家藥品監督管理局批准,並於2022.6.19正式全國上市。
成份
活性成份:奧加伊妥珠單抗。
奧加伊妥珠單抗是一種靶向CD22的抗體-藥物偶聯物(ADC),由三個部分組成:1重組人源化免疫球蛋白G亞型 4(IgG4)kappa 抗體伊珠單抗,可特異性識別人CD22;2N-乙醯-γ-刺孢黴素,可導致雙鏈 DNA 斷裂;以及3可酸解的連線子,由 4-(4'4-乙醯苯氧基)-丁酸 (AcBut) 和 3-甲基-3-巰基丁烷醯肼(被稱為二甲醯肼,將 N-乙醯-γ-刺孢黴素與伊珠單抗共價結合)組成。
奧加伊妥珠單抗的分子量約為160 kDa。與每個伊珠單抗分子結合的刺孢黴素衍生物的平均數量大約 6 個(分布範圍為2–8個)。奧加伊妥珠單抗是通過抗體與小分子成分化學結合產生的。抗體由哺乳動物(中國倉鼠卵巢)細胞產生,而半合成刺孢黴素衍生物則是通過微生物發酵、然後合成改性產生的。
化學名稱:人源化IgG4單克隆抗體與N-乙醯刺孢黴素的偶聯物(通過連線子),平均負載量為每摩爾抗體負載6摩爾刺孢黴素衍生物。
分子量:奧加伊妥珠單抗的聚糖組成及每個伊珠單抗分子結合的刺孢黴素衍生物的數量不均一。 因此,無確定的分子量。 對於具有G0F / G0F糖型和6個刺孢黴素衍生物的奧加伊妥珠單抗分子,理論分子量為159,256 Da。
輔料:氨丁三醇、蔗糖、聚山梨酯80和氯化鈉
性狀
本品為白色至類白色塊狀物或粉末。
適應症
本品適用於復發性或難治性前體B細胞急性淋巴細胞性白血病(ALL)成年患者。
規格
1.0 mg/瓶。
用法用量
推薦劑量
- 在每次給藥前預先處理(參見下文)。
- 第一個周期,針對所有患者,本品每個周期的推薦總劑量為 1.8 mg/m,分 3 次給藥,分別在第 1 天(0.8 mg/m)、第 8 天(0.5 mg/m)和第 15 天(0.5 mg/m)給藥。第 1 周期的持續時間為 3 周,但如果患者達到完全緩解(CR)或完全緩解伴血液學不完全恢復(CRi),以及/或者為從毒性中恢復,則可以將第 1 周期延長至 4 周。
- 在後續周期內:
- 對於達到 CR 或 CRi 的患者,本品每個周期的推薦總劑量為 1.5 mg/m,分 3 次給藥,分別在第 1 天(0.5 mg/m)、第 8 天(0.5 mg/m)和第 15 天(0.5 mg/m)給藥。後續周期的持續時間均為 4 周。或
- 對於未達到 CR 或 CRi 的患者,本品每個周期的推薦總劑量為 1.8 mg/m,分 3 次給藥,分別在第 1 天(0.8 mg/m)、第 8 天(0.5 mg/m)和第 15 天(0.5 mg/m)給藥。後續周期的持續時間均為 4 周。在 3 個周期內未達到 CR/CRi 的患者應停止本品治療。
對於需要接受造血幹細胞移植(HSCT)的患者,則推薦的本品的治療周期為 2 個。對於在 2 個周期的治療後仍未達到 CR/CRi 和未獲得微小殘留病(MRD)反應的患者,可以考慮對其進行第三個周期的治療(參見【注意事項】)。
對於不需要接受HSCT的患者,可接受後續治療,最大周期數不超過6個。
禁忌
- 對本品活性成份或任何輔料過敏的患者(參見【成份】)
- 既往發生經確認的重度或存在持續性VOD/SOS 的患者。
- 患有嚴重的持續性肝病(例如肝硬化、結節性再生性增生、活動性肝炎)的患者。
臨床試驗
復發性或難治性 ALL 患者 - INO-VATE ALL
在 INO-VATE ALL(NCT01564784)(在復發性或難治性 ALL 患者中進行的一項隨機 (1:1)開放國際多中心研究)中,評估了奧加伊妥珠單抗的安全性和療效。根據首次緩解持續時間(< 12 個月或 ≥ 12 個月,挽救治療(1 或 2 線挽救治療)和患者年齡(< 55 或 ≥ 55 歲),對患者進行隨機分層。符合資格的患者為 ≥ 18 歲費城染色體陰性或費城染色體陽性的復發性或難治性前體 B 細胞ALL 患者。要求所有患者的骨髓原始細胞≥ 5%,並且既往接受過 1 或 2 個 ALL誘導化療。費城染色體陽性前體 B 細胞ALL 患者需要接受過至少 1 種酪氨酸激酶抑制劑和標準化療治療並且治療失敗。表 1為患者的給藥方案。
在隨機分組接受奧加伊妥珠單抗(N=164)或研究者所選化療方案(N=162)的共 326名患者中,215(66%)名患者既往接受過 1 個ALL 治療方案,108(33%)名患者既往接受過 2個ALL治療方案。中位年齡為 47 歲(範圍:18–79 歲),276(85%)名患者費城染色體陰性 ALL,206(63%)名患者的首次緩解持續時間 < 12 個月,55(17%)名患者在接受奧加伊妥珠單抗或研究者所選化療方案之前已經接受了一次 HSCT。兩個治療組的基線人口統計學和疾病特徵總體上平衡良好。
所有可評估的患者均患有CD22 陽性前體 B 細胞 ALL,根據中心實驗室進行的流式細胞術測定,其中 ≥ 90% 的可評估患者在治療前白血病原始細胞 CD22 陽性≥ 70%。
在最初 218 名隨機分組患者中,根據 CR、CR 持續時間和 MRD 反應 CR比例(通過流式細胞術測定,骨髓有核細胞中的白血病細胞 < 1 x 10),確定奧加伊妥珠單抗的療效。最初的 218 名隨機分組患者的 CR、緩解持續時間(DoR)和 MRD 結果與全部 326 名隨機分組患者的結果一致。
在最初的 218 名隨機分組患者中,根據終點評審委員會(EAC)的判斷,奧加伊妥珠單抗組在第 1 和第 2 周期分別有 64/88(73%)和 21/88(24%)名患者達到CR/CRi;根據 EAC的判斷,研究者所選化療方案組在第 1 和第 2 周期分別有 29/32(91%)和 1/32(3%)名患者達到CR/CRi。
表 8為本研究的有效性結果。
表 8. 復發性或難治性前體 B 細胞ALL 患者接受奧加伊妥珠單抗或研究者所選化療方案(FLAG、MXN/Ara-C 或 HIDAC)後的有效性結果
CR | CRi | CR/CRi | ||||||
奧加伊妥珠單抗(N=109) | HIDAC、 FLAG 或 MXN/Ara-C(N=109) | 奧加伊妥珠單抗(N=109) | HIDAC、 FLAG 或 MXN/Ara-C(N=109) | 奧加伊妥珠單抗(N=109) | HIDAC、 FLAG 或 MXN/Ara-C(N=109) | |||
應答(CR/Cri) 患者 | ||||||||
n (%) [95% CI] | 39 (35.8) [26.8–45.5] | 19 (17.4) [10.8–25.9] | 49 (45.0) [35.4–54.8] | 13 (11.9) [6.5–19.5] | 88 (80.7) [72.1–87.7] | 32 (29.4) [21.0– 38.8] | ||
P 值 | < 0.0001 | |||||||
DoR | ||||||||
n | 39 | 18 | 45 | 14 | 84 | 32 | ||
中位數,月 [95% CI] | 8.0 [4.9–10.4] | 4.9 [2.9–7.2] | 4.6 [3.7–5.7] | 2.9 [0.6–5.7] | 5.4 [4.2–8.0] | 3.5 [2.9–6.6] | ||
MRD 反應 | ||||||||
n | 35 | 6 | 34 | 3 | 69 | 9 | ||
比率 (%) [95% CI] | 35/39 (89.7) [75.8–97.1] | 6/19 (31.6) [12.6–56.6] | 34/49 (69.4) [54.6–81.7] | 3/13 (23.1) [5.0–53.8] | 69/88 (78.4) [68.4–86.5] | 9/32 (28.1) [13.7–46.7] | ||
- 縮略語:CI=置信區間;CR=完全緩解;CRi=完全緩解伴血液學不完全恢復;DoR=緩解持續時間;EAC=終點評審委員會;FLAG=氟達拉濱 + 阿糖胞苷 + 粒細胞集落刺激因子;HIDAC=高劑量阿糖胞苷;HR=風險比;MRD=微小殘留病;MXN/AraC=米托蒽醌 + 阿糖胞苷;N/n=患者人數;OS=總生存期;PFS=無進展生存期。
- 根據 EAC,CR 定義為骨髓中原始細胞 < 5%,並且外周血中無白血病原始細胞,外周血計數完全恢復(血小板 ≥ 100 × 10/ L 和 [ANC] ≥ 1 × 10/L),以及髓外疾病緩解。
- 根據 EAC,CRi定義為骨髓中原始細胞 < 5%,並且外周血中無白血病原始細胞,外周血計數不完全恢復(血小板 < 100 × 10/L 和/或 ANC < 1 × 10/L),以及髓外疾病緩解。
- 使用卡方檢驗單側 P 值。
- DoR,基於晚於 CR/CRi 的截止日期,對研究者評估為已達到 CR/CRi 的患者,其定義為從根據研究者評估首次出現 CR 或 CRi到 PFS 事件日期或審查日期(如果無記錄到 PFS 事件)之間的時間。
- MRD反應則被定義為:採用足夠敏感的檢測方法,骨髓MRD水平降低至10以下。
- 根據 EAC,比率定義為達到 MRD 反應的患者數量除以達到 CR/CRi 的患者總數。
在最初的 218 名患者中,根據 EAC 評估,奧加伊妥珠單抗組有 32/109 名患者(29%)達到完全緩解伴血液學部分恢復(CRh;定義為骨髓中原始細胞 < 5%,ANC > 0.5 x 10/L,血小板計數 > 50 x 10/L,但是不滿足外周血計數完全恢復),而研究者所選化療方案組為 6/109 名患者(6%)。奧加伊妥珠單抗組有 71/109 名患者(65%)達到 CR/CRh,而研究者所選化療方案組為 25/109 名患者(23%)。
總體上,奧加伊妥珠單抗組和研究者所選化療方案組分別有 79/164(48%)名患者和 35/162(22%)名患者接受了後續 HSCT。
圖 1為總生存期(OS)分析。OS 分析未達到統計學意義的邊界線。
圖 1. 總生存期的 Kaplan-Meier 曲線(意向性治療人群)
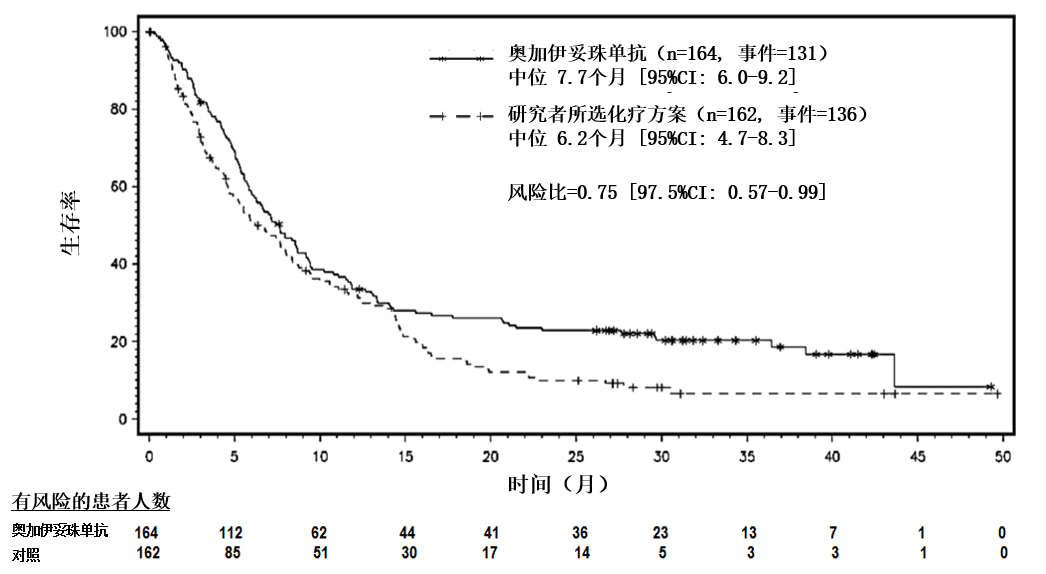
總生存期的 Kaplan-Meier 曲線(意向性治療人群)
貯藏
在原始包裝中避光冷藏(2-8℃)及運輸。請勿凍存。
復溶和稀釋後的儲存條件參見【用法用量】。
包裝
琥珀色 I 型玻璃容器、膠塞及鋁塑蓋,1支/盒。
有效期
60個月。
執行標準
進口藥品註冊標準:JS20210046
批准文號
國藥準字SJ20210033
生產企業
企業名稱:Wyeth Pharmaceutical Division of Wyeth Holdings LLC
生產地址:401 North Middletown Road, Pearl River, NY 10965, United States of America.
境內聯繫機構:
名稱:輝瑞投資有限公司
地址:北京市東城區朝陽門北大街3-7號五礦廣場B座8-13層
郵編:100010
電話:010-85167000
產品諮詢熱線:400 910 0055
