氧酸性質
氧酸是一種不存在的物質。
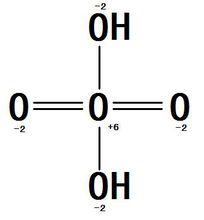
氧酸是
硫酸(H
2SO
4)的等電子體,圖中的雙鍵其實是
配位鍵,因此O原子為
sp3雜化,用於成鍵的雜化軌道為4個。畫成雙鍵是由於
鍵能相近。
至於中心氧原子的
化合價有很大爭議,有很多科學家認為是0價。
四聚氧(與三氧化硫同結構的平面三角形結構的同分異構體,而不是與環丁烷同結構的正方形的同分異構體)是氧酸的形式酸酐。並不會與水化合生成氧酸(就像與二氧化硫互為等電子體且同結構的臭氧不會與水化合生成亞氧酸一樣)。
將四聚氧(平面三角形結構)通入純氧酸中即可製得焦氧酸(H2O2O7)(並不真實存在)。
穩定性
不同的含氧酸的
穩定性相差很大,同一元素的含氧酸,高氧化態的酸比低氧化態的酸穩定。
如:HClO4> HClO3> HClO2> HClO;H2SO4>H2SO3 ; HNO3>HNO2
氧化還原性
(1)同一周期主族元素和過渡元素最高價含氧酸氧化性隨原子序數遞增而增強。如:H4SiO4<H3PO4<H2SO4<HClO4V2O5<Cr2O72-<MnO4-
(2)相應價態,同一周期的主族元素的含氧酸氧化性大於副族元素。
如: BrO4->MnO4-; SeO42->Cr2O72-
(3)同一元素不同氧化態的含氧酸中,低氧化態的氧化性較強。
如: HClO>HClO2;HNO2>HNO3(稀)
(4)在同一主族中,各元素的最高氧化態含氧酸的氧化性,大多是隨原子序數增加呈鋸齒形升高;
如 HNO3 >H3PO4 <H3AsO4 ;H2SO4< H2SeO4>H6TeO6 ;HClO4<HBrO4>H5IO6低氧化態則自上而下有規律遞減. HClO>HBrO>HIO
(5) 濃酸的含氧酸氧化性比稀酸強;含氧酸的氧化性一般比相應鹽的氧化性強;同一種含氧酸鹽在酸性介質中比在鹼性介質中氧化性強.
影響因素
影響含氧酸(鹽)氧化能力的因素
中心原子結合電子的能力
含氧酸(鹽)的氧化能力系指處於高氧化態的中心原子在它轉變為低氧化態的過程中獲得電子的能力,這種能力與它的電負性、原子半徑及氧化態等因素有關。若中心原子半徑小,電負性大,獲得電子的能力強,其含氧酸(鹽)的氧化性也就強,反之,氧化性則弱。同一周期的元素,自左往右,電負性增大,半徑減小,所以它們的最高氧化態含氧酸的氧化性依次遞增。同一族元素,從上至下,電負性減小,原子半徑增大,所以低氧化態含氧酸(鹽)的氧化性依次遞減。高氧化態氧化性鋸齒形變化,則是由於次級周期性引起的。
含氧酸分子的穩定性
含氧酸的氧化性和分子的穩定性有關,一般來說,如果含氧酸分子中的中心原子R多變價,分子又不穩定,其氧化性越強。含氧酸分子的穩定性與分子中R-O鍵的強度和鍵的數目有關。鍵的數目越多,R-O鍵強度越大,要斷裂這些鍵,使高氧化態的含氧酸還原為低氧化態甚至為單質,就比較困難,所以,穩定的多變價元素的含氧酸氧化性很弱,甚至沒有氧化性。R-O鍵的強度和數目與R的電子構型、氧化態、原子半徑、成鍵情況以及分子中帶正電性的H原子對R的反極化作用等因素有關。例如:在HClO、HClO2、HClO3、HClO4系列中,由於酸分子中R-O鍵數目依次增加,R-O鍵鍵長減小,穩定性依次增加,因而,氧化性隨氯的氧化態增加而依次減弱。HClO>HClO2>HClO3>HClO4低氧化態含氧酸氧化性強還和它的酸性弱有關,因為在弱酸分子中存在著帶正電性的氫原子,對酸分子中的R原子有反極化作用,使R-O鍵易於斷裂,同理可以解釋:①為什麼濃酸的氧化性比稀酸強?因為在濃酸溶液中存在著自由的酸分子,有反極化作用。②為什麼含氧酸的氧化性比含氧酸強?因為含氧酸鹽中Mn+反極化作用比H+弱,含氧酸鹽比含氧酸穩定。
其他外界因素的影響
溶液的酸鹼性、溫度以及伴隨氧化還原反應同時進行的其他非氧化還原過程(如水的生成、溶劑化和反溶劑化作用、沉澱生成、締合等)對含氧酸的氧化性有影響。

