基本介紹
- 中文名:氧化還原電對
- 外文名:oxidation-reduction couples
- 實質:氧化和還原型物質構成的共軛體系
- 歸屬:氧化還原反應
- 特點:包含氧化和還原兩個半反應
- 表示:氧化型/還原型
氧化還原電對和原電池
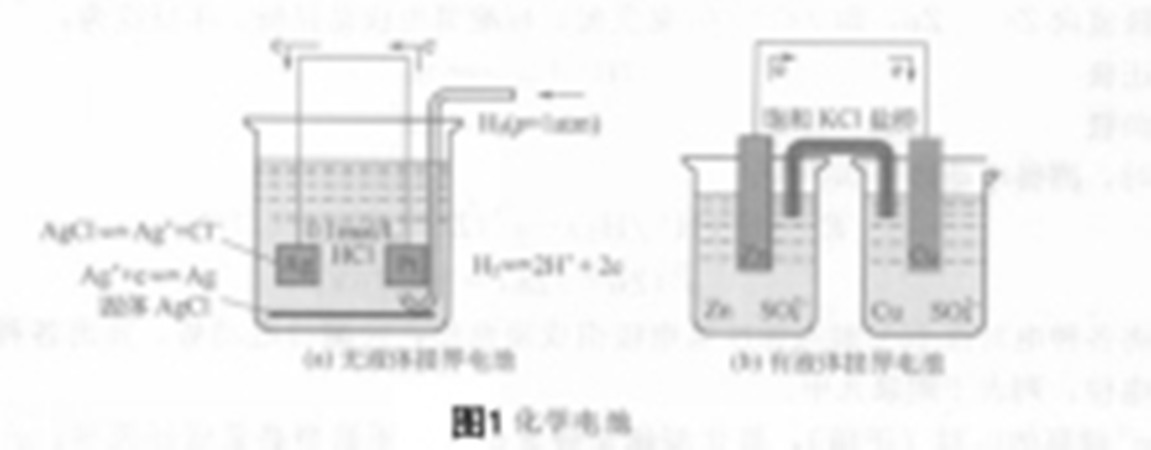


任何一個氧化還原反應都可以看成是兩個半反應之和:一個是氧化劑(氧化型)在反應過程中氧化數降低,氧化型轉化為還原型的半反應,另一個是還原劑(還原型)在反應過程中氧化數升高、還原型轉化為氧化型的半反應。一對氧化型和還原型物質...
每個電極上所發生的氧化(或還原)反應稱半電池反應或半反應。每個半反應都是由同一元素的兩種不同氧化數的物質組成,其中氧化數高的稱為氧化型,氧化數低的稱還原型,它們構成氧化還原電對,簡稱電對。用符號表示成氧化型/還原型。如電...
氧化還原對 氧化還原對(redox couple)是2016年公布的化學名詞。定義 由參與氧化還原反應的氧化和還原組分構成的共存電對。出處 《化學名詞》第二版。
《Li+/Li電對電化學氧化還原動力學行為研究》是依託北京理工大學,由張存中擔任項目負責人的面上項目。項目摘要 由於鋰空氣電池、鋰硫電池有出色的高能量密度特點,近些年得到廣泛關注和迅速發展。圍繞這兩種鋰電池的安全性和循環效率,本...
氧化還原反應的發生條件,從熱力學角度來說,是反應的自由能小於零;從電化學角度來說,是對應原電池的電動勢大於零。氧化-還原平衡 一般來說,所有的化學反應都具有可逆性,只是可逆的程度有很大差別,各反應進行的限度也大不相同。因此...
氧化還原電位對一個水體來說,往往存在多種氧化還原電對,構成複雜的氧化還原體系,而其氧化還原電位是多種氧化物質與還原物質發生氧化還原反應的綜合結果。不論反應形式如何,所謂氧化即失去電子,所謂還原即得到電子,一定伴有電子的授受...
氧化反應往往是可逆的,在還原劑供出電子後變成氧化劑,作為氧化劑又可以接受電子變成還原劑。還原劑失去電子的傾向(或氧化劑得到電子的傾向)的大小,則稱為氧化還原電勢。在標準條件下,每一個氧化還原電對都有一個標準的氧化還原電勢...
全釩氧化還原液流電池,簡稱為釩電池(Vanadium Redox Battery,縮寫為VRB),是一種活性物質呈循環流動液態的氧化還原電池。概念 全釩氧化還原液流電池是一種蓄電池,利用釩離子在不同氧化態下的不同化學勢能保存能量。具有充放電效率高...
每一個氧化還原反應都可以做成一個原電池。其中發生氧化反應的一極為陽極,即外電路的負極;還原反應的一極為陰極,即外電路的正極。兩個電極之間有電勢差(電化學上通常叫電動勢),因此反應可以進行,同時可以用來做功。氧化反應 氧化...
與酸鹼滴定法和配位滴定法相比較,氧化還原滴定法套用非常廣泛,它不僅可用於無機分析,而且可以廣泛用於有機分析,許多具有氧化性或還原性的有機化合物可以用氧化還原滴定法來加以測定。相關概念 可逆電對 (1)能迅速建立起氧化還原平衡...
基於電化學催化氧氣還原反應(ORR)機理,利用密度泛函理論(DFT)計算不同結構的PtM合金催化劑、過渡金屬氧化物催化劑的幾何、電子構型與其催化氧還原活性,建立了催化劑結構與氧還原反應機理的關係,發現了:(1)PtM/Pd三元合金中摻雜...
環境氧化還原電位(oxidation reduction potential from surroundings):在統一的系統中,各種變價元素的氧化還原半反應的電位是相互影響的,對於某一種變價元素來說,其他所有變價元素的氧化還原電位總和構成該元素的環境氧化還原電位。由於...
氧化還原液流電池 氧化還原液流電池(redox flow battery)是2016年全國科學技術名詞審定委員會公布的化學名詞,出自《化學名詞》第二版。定義 由電解液中的氧化還原活性物質和惰性電極組成的電池。出處 《化學名詞》第二版 ...
氧化-還原電位測定儀 氧化-還原電位測定儀指的是測定浸在水溶液中的金屬電極和參比電極間電動勢的儀器。輸出電動勢與處於氧化態和還原態的物質活度有關,並符合能斯特公式。簡介
釩電池,全稱是全釩液流電池(Vanadium Redox Flow Battery,VRB),是一種活性物質呈循環流動液態的氧化還原電池。早在60年代,就有鐵—鉻體系的氧化還原電池問世,但是釩系的氧化還原電池是在1985年由澳大利亞新南威爾斯大學的Marria Ka...
二、離子濃度改變對氧化還原反應方向的影響 非標準狀態下對於兩個電勢比較接近的電對,僅用標準電勢來判斷反應方向是不夠的,應該考慮離子濃度改變對反應方向的影響。三、介質酸度對氧化還原反應的影響及pH電勢圖 ...
條件電位的大小反映了在外界因素影響下,氧化還原電對的實際氧化還原能力。套用條件電位比用標準電極電位能更正確地判斷氧化還原反應的方向、次序和反應完成的程度。基本性質 氧化劑和還原劑的氧化還原能力可以用相關電對的電極電位(簡稱電位...
4. 非金屬或氣體不導電,因此非金屬元素在不同氧化值時構成的氧化還原電對作半電池時,需外加惰性導體(如鉑或石墨等)做電極導體。其中,惰性導體不參與電極反應,只起導電(輸送或接送電子)的作用,故稱為“惰性”電極。按上述規定...
氧化還原反應的發生條件,從熱力學角度來說,是反應的自由能小於零;從電化學角度來說,是對應原電池的電動勢大於零。電池種類 乾電池 乾電池也叫錳鋅電池,所謂乾電池是相對於伏打電池而言,所謂錳鋅是指其原材料。針對其它材料的乾...
將不同氧化還原電對的標準電極電勢數值按照由小到大的順序排列,得到電極反應的標準電極電勢表。其特點有:(1)一般採用電極反應的還原電勢,每一電極的電極反應均寫成還原反應形式,即:氧化型+ne⁻=還原型。(2)標準電極電勢是平衡...
電解(Electrolysis)是將電流通過電解質溶液或熔融態電解質,在陰極和陽極上引起氧化還原反應的過程,電化學電池在外加直流電壓時可發生電解過程。電解是利用在作為電子導體的電極與作為離子導體的電解質的界面上發生的電化學反應進行化學品...
結構最簡單的電極應包括兩個物相和一個相界面,即〔金屬|電液〕。上述定義的電極也稱“半電池”。命名 命名方式很複雜,有些根據電極的金屬部分命名,如銅電極、鉑電極等;有些根據電極活性的氧化還原對中的特徵物質命名,如甘汞電極、...
