基本介紹
- 中文名:氟化鋇
- 英文名:Barium fluoride
- 別稱:氟化鋇(II)
- 化學式:BaF2
- 分子量:175.34
- CAS登錄號:7787-32-8
- EINECS登錄號:232-108-0
- 熔點:1368℃
- 沸點:2260℃
- 水溶性:微溶於水
- 密度:4.893g/cm3
- 外觀:白色立方晶體
- 危險性符號:Xn,T
- 危險品運輸編號:UN 2811 6.1/PG 3
計算化學數據,性質與穩定性,物質結構,物質用途,製備或來源,乾法,濕法,貯存方法,毒理學數據,生態學數據,
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:0
3、氫鍵受體數量:2
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:0
7、重原子數量:3
8、表面電荷:0
9、複雜度:0
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:3
性質與穩定性
如果遵照規格使用和儲存則不會分解,未有已知危險發生。
溶解度數據如下表所示。較氟化鈣、氟化鍶易溶,易溶於酸及氯化銨的水溶液中。
溫度℃ | 10 | 20 | 30 |
溶解度g/100g水 | 0.159 | 0.160 | 0.162 |
本品有毒,吸入有害。
物質結構
氟化鋇是鹼土氟化物晶體,無色透明,屬於立方晶體系,面心立方結構型(見圖1 a)。是配位型晶體,每個鋇原子周圍有八個氟離子包圍,構成陰離子立方休結構基元(見圖1 b),而F被四個Ba所環繞構成四面體結構基元,Ba位於立方面心格位呈緊密堆積(見右圖)。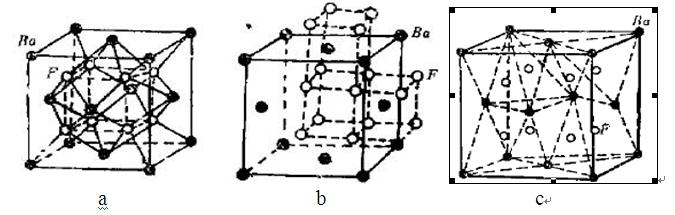

固態氟化鋇為螢石型晶體結構,立方晶系。高壓下轉變為氯化鉛型結構。
氣態時,以 BaF2 分子的形式存在,F-Ba-F 鍵角約為 108°,與價層電子對互斥理論的預測相矛盾。 從頭計算的結果顯示這是鋇原子的 d 軌道參與的結果。 也有理論認為這是由鋇內層電子的極化作用,在鋇原子周圍產生四面體型的電荷分布,並與 Ba-F 鍵發生作用造成的。
物質用途
製備或來源
乾法
乾法又稱固相合成法,是利用氟矽酸鋇在高溫下分解為產品氟化鋇及四氟化矽氣體,原料氟矽酸鋇可以從磷肥行業的副產物氟矽酸經銨化後,再與氫氧化鋇或碳酸鋇反應得到,四氟化矽氣體經吸收後重新再利用。所涉及到的反應方程式:

優缺點:所用原料易得,價格低廉,製備工藝簡單,所需設備較少,反應的副產物容易處理,生產過程無廢水、廢液排放,不產生二次污染,具有良好的經濟效益與環境效益。但熱分解所需要的溫度較高,能耗大,對生產設備要求高。氟矽酸鋇高溫熱解時,傳熱不均勻,容易造成結壁現象,從而加大能耗,同時也會影響到最終固體產品的純度,使用流化床進行熱分解可以解決此問題。
濕法
以氟化氫為氟源:利用碳酸鋇或氫氧化鋇直接或間接與氫氟酸反應。反應方程式如下:

優缺點:生產工藝比較成熟,原料利用率較高,反應產生副產物氣體和水,氟化鋇結晶時不受其他離子的影響,容易由高純的原料製取純度較高的產品。但設備腐蝕嚴重,生產時直接或間接需要大量的氫氟酸,氫氟酸主要由螢石和硫酸反應製得,現在中國加大限制螢石開採的力度,相應的氫氟酸的價格也必然會升高,進而影響該工藝的生產成本。另外,生產過程中伴有大量的母液排放,給環境保護造成較大壓力。
以可溶性鹽作為氟源:利用氟化鋇在水溶液中溶解度低的性質,使可溶性鋇鹽溶液和可溶性氟化鹽溶液反應生成氟化鋇沉澱。反應方程式如下:
Ba2++2F-→BaF2↓
如:以氟化銨作為氟源,用氯化鋇溶液和氟化銨通過水浴加熱反應生成氟化鋇沉澱。
BaCl2+NH4F→BaF2↓+2NH4Cl
具體操作步驟為:稱取一定量的BaCl2·2H2O溶於蒸餾水中,將溶液置於設定溫度的恆溫水浴中加熱。將一定量的氟化銨粉末快速加入到氯化鋇溶液中並攪拌,反應一定時間後,抽濾,洗滌濾餅並乾燥。
優缺點:生產工藝條件溫和,原料多來源於其他行業副產的氟源及可溶性鋇鹽,價格低廉,生產氟化鋇成本較低,產品附加值較高。但氟化鋇沉澱時可能夾雜其他金屬離子或陰離子,產品純度不高。同樣,生產過程中伴隨有大量的洗滌液排放,環保壓力較大。
貯存方法
1、應貯存在通風、乾燥、清潔的庫房中,密封保存,注意防潮。
2、勿與酸類和食品共貯混運。運輸時要防雨淋和日曬。裝卸時要輕拿輕放,防止包裝破損。
毒理學數據
有毒。對眼睛、皮膚、黏膜和上呼吸道有強烈刺激作用。
生態學數據
屬其它有害作用:該物質對環境有危害,建議不要讓其進入環境。應特別注意對水體的污染。

