歐蘭同(奧拉西坦注射液),適應症為用於腦損傷及其引起的神經功能缺失、記憶與智慧型障礙的治療。
基本介紹
- 藥品名稱:歐蘭同
- 藥品類型:處方藥
- 用途分類:主要興奮大腦皮層的藥物
警示語,成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,批准文號,生產企業,核准日期,
警示語
對本品過敏者、嚴重腎功能損害者禁用
成份
本品主要成份為奧拉西坦,輔料為磷酸二氫鈉和乙二胺四乙酸二鈉鹽。
其藥物成份奧拉西坦的化學名稱: 4-羥基-2-氧代-1-吡咯烷乙醯胺
化學結構式:
分子式:C6H10N2O3
分子量:158.16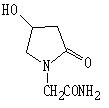
其藥物成份奧拉西坦的化學名稱: 4-羥基-2-氧代-1-吡咯烷乙醯胺
化學結構式:
分子式:C6H10N2O3
分子量:158.16

性狀
本品為幾乎無色或微黃色澄明液體。
適應症
用於腦損傷及其引起的神經功能缺失、記憶與智慧型障礙的治療。
規格
5ml:1g
用法用量
靜脈滴注,每日一次,每次4-6g,用前加入到5%葡萄糖注射液或0.9%氯化鈉注射液100-250ml中,搖勻後靜脈滴注,可酌情增減用量,用藥療程為2-3周。
國外上市奧拉西坦注射液的用量範圍是2-8g,但國內尚無低於4g、高於6g的用藥經驗。
國外上市奧拉西坦注射液的用量範圍是2-8g,但國內尚無低於4g、高於6g的用藥經驗。
不良反應
據國外文獻報導,奧拉西坦的不良反應少見,偶見皮膚瘙癢、噁心、精神興奮、頭暈、頭痛、睡眠紊亂,但症狀較輕,停藥後可自行恢復。
套用本品進行了臨床試驗,結果顯示奧拉西坦注射液組與吡拉西坦注射液的不良事件發生率無統計學差異,未發現嚴重不良事件。
套用本品進行了臨床試驗,結果顯示奧拉西坦注射液組與吡拉西坦注射液的不良事件發生率無統計學差異,未發現嚴重不良事件。
禁忌
對本品過敏者、嚴重腎功能損害者禁用。
注意事項
1、輕、中度腎功能不全者應慎用,必需使用本品時,須減量。
2、患者出現精神興奮和睡眠紊亂時,應減量。
3、當藥品性狀發生改變時,如瓶內有異物、顏色改變請勿使用。
2、患者出現精神興奮和睡眠紊亂時,應減量。
3、當藥品性狀發生改變時,如瓶內有異物、顏色改變請勿使用。
孕婦及哺乳期婦女用藥
本品在孕婦及哺乳期婦女使用的安全性尚不明確,因此,不應使用。
兒童用藥
尚不明確。
老年用藥
Lecaillon JB等對老年病人的奧拉西坦藥物代謝情況進行了研究,老年人由於生理性腎功能減退,消除半衰期較健康青年人延長,曲線下面積(AUC)及血藥峰濃度(Cmax)均略有升高,老年人在使用本品後消除速度稍慢,但與青年人相比無顯著性差異。
藥物相互作用
尚不明確。
藥物過量
在超劑量使用本品的情況下偶有病人出現興奮、失眠等不良反應,停藥或減少劑量後症狀可逐漸消失。
藥理毒理
藥理作用
本品為吡拉西坦的類似物,可改善老年性痴呆和記憶障礙症患者的記憶和學習功能。機理研究結果提示,本品可促進磷醯膽鹼和磷醯乙醇胺合成,提高大腦中ATP/ADP的比值,使大腦中蛋白質和核酸的合成增加。
毒理研究
動物研究提示:本品急性毒性低,小鼠灌胃給藥10g/kg,靜脈給藥2g/kg和大鼠灌胃給藥10g/kg均未見動物死亡;未表現出致突變、致癌作用及生殖毒性。
本品為吡拉西坦的類似物,可改善老年性痴呆和記憶障礙症患者的記憶和學習功能。機理研究結果提示,本品可促進磷醯膽鹼和磷醯乙醇胺合成,提高大腦中ATP/ADP的比值,使大腦中蛋白質和核酸的合成增加。
毒理研究
動物研究提示:本品急性毒性低,小鼠灌胃給藥10g/kg,靜脈給藥2g/kg和大鼠灌胃給藥10g/kg均未見動物死亡;未表現出致突變、致癌作用及生殖毒性。
藥代動力學
套用本品進行了人體藥代動力學研究,結果:單次靜脈滴注(2.0g)血藥峰濃度(Cmax)為96.15±3.58ug.ml[sup]-1[/sup].h[sup]-1[/sup],曲線半衰期為3.84±0.64h,曲線下面積(AUC0-12 )為256.26±16.84ug.ml[sup]-1[/sup].h[sup]-1[/sup],曲線下面積(AUC0-t )為276.74±18.11ug.ml[sup]-1[/sup].h[sup]-1[/sup],腎排泄速率常數(ke)為0.18±0.03h[sup]-1[/sup],平均滯留時間(MRT)為4.87±0.69h多次靜脈滴注(2.0g)血藥峰濃度Cmax為97.92±3.26ug.ml[sup]-1[/sup],半衰期為4.14±0.82h,曲線下面積(AUC0-12 )為259.36±25.43ug.ml[sup]-1[/sup].h[sup]-1[/sup],曲線下面積(AUC0-t )為285.59±27.38ug.ml[sup]-1[/sup].h[sup]-1[/sup],腎排泄速率常數(ke)為0.17±0.04h[sup]-1[/sup],平均滯留時間(MRT)為4.87±0.69h。奧拉西坦多次靜脈給藥體內無蓄積,靜脈給藥後,血藥濃度水平以及主要的藥代動力學參數在個體間差異較小;
文獻資料顯示:奧拉西坦在肝、腎中分布濃度較高,出腦脊液中的半衰期為300分鐘(口服2.0g)、140分鐘(靜脈注射2.0g)外,在其與組織的半衰期與血漿中相似。奧拉西坦主要通過腎臟代謝,48小時內90%以上的藥物以原型從尿中排出,個體間差異很小;老年人與健康年輕人的腎臟消除速度無顯著性差異。
文獻資料顯示:奧拉西坦在肝、腎中分布濃度較高,出腦脊液中的半衰期為300分鐘(口服2.0g)、140分鐘(靜脈注射2.0g)外,在其與組織的半衰期與血漿中相似。奧拉西坦主要通過腎臟代謝,48小時內90%以上的藥物以原型從尿中排出,個體間差異很小;老年人與健康年輕人的腎臟消除速度無顯著性差異。
貯藏
遮光,密封,在陰涼乾燥處(不超過20℃)保存。
包裝
曲徑易折玻璃安瓶,6支/盒。
有效期
暫定24個月。
執行標準
YBH01692006(試行)
批准文號
國藥準字H20060070
生產企業
哈爾濱三聯藥業有限公司
核准日期
2007年01月24日
