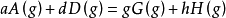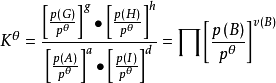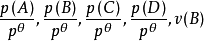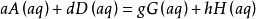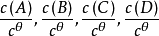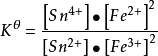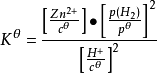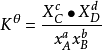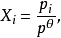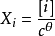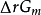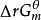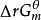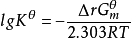背景知識
化學平衡狀態:在一定條件下,當一個可逆反應的正反應速率與逆反應速率相等時,反應物的濃度與生成物的濃度不再改變,達到一種表面靜止的狀態,即"化學平衡狀態". 其中,正反應速率與逆反應速率相等是化學平衡狀態的實質,而反應物的濃度與生成物的濃度不再改變是化學平衡狀態的表現。正反應速率與逆反應速率是針對同一
可逆反應而言,正與反只是相對而言,不是絕對概念。
定義
在一定溫度下,可逆反應達到平衡時,產物濃度計量係數次方的乘積與反應物濃度計量係數次方的乘積之比為
平衡常數。若在上面的平衡常數表達式中,若各物質均以各自的標準態為參考態,所得的平衡常數為標準平衡常數。
氣相
某一氣相其反應物和生成物都是氣體的可逆反應,例如:
在一定溫度下達到平衡,其標準平衡常數(standard equilibrium constant)表示為
上式中:p
Θ=10
5Pa,為標準壓力。各組分氣體的平衡分壓與p
Θ的比值為各組分氣體平衡時的相對分壓,如上式組分A、D、G、H平衡時的相對分壓分別為
反應B的化學總計量數。這樣使得氣體的相對分壓量綱為1,K
Θ的量綱也為1。
液相
若某可逆反應在水溶液中進行:
式中:c
Θ=1mol·L
-1,為標準濃度。各物質的平衡濃度與標準濃度的比值為各物質平衡時的相對濃度。例如,上述四組分A、D、G、H平衡時的相對濃度分別為
。由於溶質的標準態是1,其標準常數表達式中常可將c
Θ隱藏起來,將K
Θ簡寫。
例如:Sn2+(aq)+2Fe3+(aq)⇌Sn4+(aq)+2Fe2+(aq)的的標準平衡常數的表達式可簡寫為:
多相
對於多相反應,例如Zn(s)+2H+(aq)⇌H2(g)+Zn2+(aq),其標準平衡常數表達式:
純液體或純固體其活度為1,因而不出現在標準平衡常數的表達式中。
將上述三個式子合併成一個式子,即對一般反應式有
對氣體
對液體
,顯然標準平衡常數不在區分壓強平衡常數和濃度平衡常數,其量綱為1.
注意事項
(2)標準平衡常數表達式與化學反應計量式相對應。同一化學反應以不同的計量式表達時,其標準平衡常數的數值不同;
(3)代入標準平衡常數表達式中的數值為平衡狀態下各物質的相對濃度或相對分壓。若某物質是氣體,就以相對分壓來表示;若是溶液中的溶質,則以相對濃度來表示。稀溶液的溶劑,純固體或純液體的濃度不出現在表達式中。
(4)標準平衡常數的數值與系統的濃度無關,僅僅是溫度的函式。一定溫度下,標準平衡常數的數值越大,說明反應正向的程度越大。
(5)多重平衡規則。當幾個反應式相加或相減得到另一個反應式時,其平衡常數等於幾個反應平衡常數的積或者商。套用多重平衡原則,可以由已知的標準平衡常數預測未知反應的標準平衡常數。
化學反應等溫式
通常情況下,反應系統不一定處於標準態,而是任意狀態的。對於任意化學反應,根據化學熱力學推導可得在恆溫恆壓下,反應在任意狀態下的
與標準態下的
的關係方程式:
=
+RTlnJ;式子中J為反應商,的表達式要求與標準平衡常數一致。
根據最小自由能原理,當反應到達平衡態時,
=0,J =
;