基本介紹
- 藥品名稱:樂芮
- 藥品類型:處方藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,批准文號,生產企業,核准日期,
成份
主要成份:重組人促黃體激素α。通過基因工程由中國倉鼠(CHO)卵巢細胞生產。
賦形劑:蔗糖、磷酸氫二鈉、磷酸二氫鈉、吐溫20及蛋氨酸。
賦形劑:蔗糖、磷酸氫二鈉、磷酸二氫鈉、吐溫20及蛋氨酸。
性狀
本品為白色凍乾粉及無色澄清的注射用溶劑。
適應症
嚴重缺乏LH和FSH的患者,即內源性的血清LH水平[1.2IU/L的患者。推薦Luveris®與促卵泡激素(FSH)聯合使用以刺激卵泡的發育。
規格
75IU。
用法用量
使用Luveris®最初應在有治療不孕症經驗的醫生指導下進行。只有經過良好的指導、適當的培訓且可接受專家建議的患者才能進行自我用藥。
缺乏LH和FSH的婦女,Luveris®和FSH聯合使用的目的是形成單個成熟的格拉夫卵泡,而此卵泡是在使用人絨毛膜促性腺激素(hCG)後由卵母細胞釋放。在一個療程中,Luveris®應每天與FSH同時注射。由於閉經且內源性雌激素分泌水平低,對這些患者的治療可隨時進行。
對此適應症所有已獲得的臨床經驗均來自與促卵泡激素α的聯合使用。
Luveris用於皮下注射,用藥前即刻將凍乾粉溶於所提供的溶劑中。
本品的治療應根據患者對下列指標的反應因人而異:(i)超聲檢測卵泡的大小(ii)雌激素反應。推薦的起始劑量每天75IU促黃體激素α(即1瓶Luveris)聯合使用75-150IU的FSH。
如果增加FSH劑量,其遞增量最好為37.5IU-75IU,且劑量的調整最好在7-14天的間隔後。刺激時間可從任一治療周期延長至最多5周。
當達到滿意的反應時,應在末次注射Luveris®及促卵泡激素(FSH)24-48小時後一次性注射絨毛膜促性腺激素(hCG)5,000IU-10,000IU。建議患者在注射人絨毛膜促性腺激素(hCG)當日和次日進行性生活,或進行子宮內授精(IUI)。
由於缺乏具有促黃體的活性物質(LH/hCG),排卵後可能導致黃體的過早破壞,應考慮給予黃體相支持。
如果反應過度,應停止治療,同時停用人絨毛膜促性腺激素(見注意事項)。推薦在下一個周期以較低劑量重新開始治療。
自我用藥指導:
1.洗手。保持手和使用的物品清潔是很重要的。
2.準備好所需的物品。準備一個乾淨的區域並擺好每樣物品:一瓶Luveris、一瓶溶劑、兩個酒精棉球、一個注射器、一枚用於溶解藥品的大針頭、一枚用於皮下注射的細孔針頭及用於裝尖銳器械廢棄物的容器。
3.抽取溶劑:除去溶劑小瓶的保護蓋。將溶解用的針頭(大的針頭)連線到注射器上,並把針栓拉到約1ml的標記處,抽一些空氣到注射器中。然後將針頭插入小瓶中,推動針栓排出空氣,將小瓶倒轉,輕輕抽出所有的溶劑。
小心將注射器放在工作檯表面,注意勿觸到針頭。
4.準備注射液:除去裝有Luveris凍乾粉小瓶的保護蓋,拿起注射器並緩慢將溶劑注入Luveris小瓶中。輕輕旋轉未抽出注射器的小瓶,勿振搖。
粉末溶解後(通常是立即溶解),確認溶液是否澄清並不含顆粒。將小瓶倒置,輕輕將溶液抽回到注射器中。
可以將Luveris與促卵泡激素α混合使用來代替分別使用二者。Luveris凍乾粉溶解後將溶液抽回注射器然後注入盛有促卵泡激素α凍乾粉的小瓶中,藥粉溶解後將溶液抽回到注射器中,參照上述方法檢查顆粒,若溶液不澄清則不得使用。
1ml溶劑最多可溶解3支凍乾粉。
5.注射:將針頭換成細孔針頭並排出所有氣泡。如注射器中有氣泡,應手持注射器將針頭朝上並輕彈注射器,直到所有氣泡集中到頂部。輕輕推動針栓直到氣泡排出。
6.立即注射藥液:醫生和護士會建議下列注射部位:如腹部,大腿前。用酒精棉球擦拭選好的部位,捏緊並固定皮膚,以45°到90°的角度將針頭快速刺入,按醫生或護士教授的方法在皮膚下注射,勿直接注射到靜脈中。注射所需時間由自己掌握,輕輕推動針栓待全部藥液注入後,立即拔出針頭並用酒精棉球轉圈兒清潔局部皮膚。
7.處置所有用過的物品:一旦注射完成,立即將所有的針頭和空的玻璃瓶棄至裝尖銳器械廢棄物的容器中。任何未用的溶液也必須丟棄。
使用、操作及處置的說明:
本品打開並溶解後應立即使用,且只能一次性使用。
凍乾粉使用前應緩慢旋轉以溶劑溶解。
溶解後的液體如果含有顆粒或不澄清,則不得使用。
Luveris與促卵泡激素α混合後可同時且一次性使用。在這種情況下,應先溶解Luveris,然後再用所得的溶液溶解促卵泡激素α凍乾粉。
為了避免注射體積過大,1瓶Luveris®可與1-2支(或瓶)促卵泡激素α:37.5IU,75IU及150IU以 1ml溶劑溶解。
任何剩餘的藥品或廢棄物應依照當地的要求處置。
藥瓶上標註的有效期後不得使用。
若有任何可見的瑕疵,如:藥粉變色或藥瓶破損,則不得使用。
缺乏LH和FSH的婦女,Luveris®和FSH聯合使用的目的是形成單個成熟的格拉夫卵泡,而此卵泡是在使用人絨毛膜促性腺激素(hCG)後由卵母細胞釋放。在一個療程中,Luveris®應每天與FSH同時注射。由於閉經且內源性雌激素分泌水平低,對這些患者的治療可隨時進行。
對此適應症所有已獲得的臨床經驗均來自與促卵泡激素α的聯合使用。
Luveris用於皮下注射,用藥前即刻將凍乾粉溶於所提供的溶劑中。
本品的治療應根據患者對下列指標的反應因人而異:(i)超聲檢測卵泡的大小(ii)雌激素反應。推薦的起始劑量每天75IU促黃體激素α(即1瓶Luveris)聯合使用75-150IU的FSH。
如果增加FSH劑量,其遞增量最好為37.5IU-75IU,且劑量的調整最好在7-14天的間隔後。刺激時間可從任一治療周期延長至最多5周。
當達到滿意的反應時,應在末次注射Luveris®及促卵泡激素(FSH)24-48小時後一次性注射絨毛膜促性腺激素(hCG)5,000IU-10,000IU。建議患者在注射人絨毛膜促性腺激素(hCG)當日和次日進行性生活,或進行子宮內授精(IUI)。
由於缺乏具有促黃體的活性物質(LH/hCG),排卵後可能導致黃體的過早破壞,應考慮給予黃體相支持。
如果反應過度,應停止治療,同時停用人絨毛膜促性腺激素(見注意事項)。推薦在下一個周期以較低劑量重新開始治療。
自我用藥指導:
1.洗手。保持手和使用的物品清潔是很重要的。
2.準備好所需的物品。準備一個乾淨的區域並擺好每樣物品:一瓶Luveris、一瓶溶劑、兩個酒精棉球、一個注射器、一枚用於溶解藥品的大針頭、一枚用於皮下注射的細孔針頭及用於裝尖銳器械廢棄物的容器。
3.抽取溶劑:除去溶劑小瓶的保護蓋。將溶解用的針頭(大的針頭)連線到注射器上,並把針栓拉到約1ml的標記處,抽一些空氣到注射器中。然後將針頭插入小瓶中,推動針栓排出空氣,將小瓶倒轉,輕輕抽出所有的溶劑。
小心將注射器放在工作檯表面,注意勿觸到針頭。
4.準備注射液:除去裝有Luveris凍乾粉小瓶的保護蓋,拿起注射器並緩慢將溶劑注入Luveris小瓶中。輕輕旋轉未抽出注射器的小瓶,勿振搖。
粉末溶解後(通常是立即溶解),確認溶液是否澄清並不含顆粒。將小瓶倒置,輕輕將溶液抽回到注射器中。
可以將Luveris與促卵泡激素α混合使用來代替分別使用二者。Luveris凍乾粉溶解後將溶液抽回注射器然後注入盛有促卵泡激素α凍乾粉的小瓶中,藥粉溶解後將溶液抽回到注射器中,參照上述方法檢查顆粒,若溶液不澄清則不得使用。
1ml溶劑最多可溶解3支凍乾粉。
5.注射:將針頭換成細孔針頭並排出所有氣泡。如注射器中有氣泡,應手持注射器將針頭朝上並輕彈注射器,直到所有氣泡集中到頂部。輕輕推動針栓直到氣泡排出。
6.立即注射藥液:醫生和護士會建議下列注射部位:如腹部,大腿前。用酒精棉球擦拭選好的部位,捏緊並固定皮膚,以45°到90°的角度將針頭快速刺入,按醫生或護士教授的方法在皮膚下注射,勿直接注射到靜脈中。注射所需時間由自己掌握,輕輕推動針栓待全部藥液注入後,立即拔出針頭並用酒精棉球轉圈兒清潔局部皮膚。
7.處置所有用過的物品:一旦注射完成,立即將所有的針頭和空的玻璃瓶棄至裝尖銳器械廢棄物的容器中。任何未用的溶液也必須丟棄。
使用、操作及處置的說明:
本品打開並溶解後應立即使用,且只能一次性使用。
凍乾粉使用前應緩慢旋轉以溶劑溶解。
溶解後的液體如果含有顆粒或不澄清,則不得使用。
Luveris與促卵泡激素α混合後可同時且一次性使用。在這種情況下,應先溶解Luveris,然後再用所得的溶液溶解促卵泡激素α凍乾粉。
為了避免注射體積過大,1瓶Luveris®可與1-2支(或瓶)促卵泡激素α:37.5IU,75IU及150IU以 1ml溶劑溶解。
任何剩餘的藥品或廢棄物應依照當地的要求處置。
藥瓶上標註的有效期後不得使用。
若有任何可見的瑕疵,如:藥粉變色或藥瓶破損,則不得使用。
不良反應
a)總體描述
促黃體激素α與促卵泡激素α聯合使用以刺激卵泡發育。從這一意義上來說,難以將不良反應歸因於任何一種曾經套用過的產品。
考慮尿源性人促黃體激素(hLH)上市後的安全性經驗,除超敏反應及注射部位不適外,Luveris的不良反應與尿源性的人促黃體激素相似。
據報導,在一項臨床試驗中,注射部位輕度及中度反應(瘀腫、疼痛、發紅、瘙癢及腫脹)發生率分別為7.4%及0.9%,無嚴重注射部分反應及系統性過敏反應報告。
使用Luveris治療的患者,其卵巢過度刺激綜合症的發生率低於6%,無嚴重的卵巢過度刺激綜合症的報告(見注意事項)。
罕有血栓栓塞、附屬檔案扭轉(卵巢增大併發症)及腹膜出血與人絕經期促性腺激素治療相關,儘管未觀察到這一不良事件,但在使用Luveris®時也有可能發生這種情況。
可能發生異位妊娠,尤其是以前有輸卵管疾病史的婦女。
b)不良反應
常用下列方式表示發生頻率(事件/患者人數);極罕見:〈1/10000;罕見:〉1/10000,〈1/1000;不常見:〉1/1000,〈1/100;常見:〉1/100,〈1/10;很常見:〉1/10。
以下常見的不良反應,可能在注射Luveris®後發生:
注射部位不適:注射部位反應
全身不適:頭痛,嗜睡
胃腸系統紊亂:噁心、腹痛、盆骨疼痛
生殖系統紊亂:卵巢過度刺激綜合症、卵巢囊腫、乳房疼痛
不良反應報告與其它含hLH的藥物相仿,但用Luveris®治療時其注射部位的反應顯著低於其它藥物。
促黃體激素α與促卵泡激素α聯合使用以刺激卵泡發育。從這一意義上來說,難以將不良反應歸因於任何一種曾經套用過的產品。
考慮尿源性人促黃體激素(hLH)上市後的安全性經驗,除超敏反應及注射部位不適外,Luveris的不良反應與尿源性的人促黃體激素相似。
據報導,在一項臨床試驗中,注射部位輕度及中度反應(瘀腫、疼痛、發紅、瘙癢及腫脹)發生率分別為7.4%及0.9%,無嚴重注射部分反應及系統性過敏反應報告。
使用Luveris治療的患者,其卵巢過度刺激綜合症的發生率低於6%,無嚴重的卵巢過度刺激綜合症的報告(見注意事項)。
罕有血栓栓塞、附屬檔案扭轉(卵巢增大併發症)及腹膜出血與人絕經期促性腺激素治療相關,儘管未觀察到這一不良事件,但在使用Luveris®時也有可能發生這種情況。
可能發生異位妊娠,尤其是以前有輸卵管疾病史的婦女。
b)不良反應
常用下列方式表示發生頻率(事件/患者人數);極罕見:〈1/10000;罕見:〉1/10000,〈1/1000;不常見:〉1/1000,〈1/100;常見:〉1/100,〈1/10;很常見:〉1/10。
以下常見的不良反應,可能在注射Luveris®後發生:
注射部位不適:注射部位反應
全身不適:頭痛,嗜睡
胃腸系統紊亂:噁心、腹痛、盆骨疼痛
生殖系統紊亂:卵巢過度刺激綜合症、卵巢囊腫、乳房疼痛
不良反應報告與其它含hLH的藥物相仿,但用Luveris®治療時其注射部位的反應顯著低於其它藥物。
禁忌
Luveris禁用於以下患者:
•對促性腺激素或賦形劑過敏
•卵巢癌、子宮相關的癌症或乳腺癌
•活動性及未治療過的下丘腦和垂體腫瘤
•非多囊卵巢引起的卵巢增大或囊腫
•不明病因的生殖道出血
•對促性腺激素或賦形劑過敏
•卵巢癌、子宮相關的癌症或乳腺癌
•活動性及未治療過的下丘腦和垂體腫瘤
•非多囊卵巢引起的卵巢增大或囊腫
•不明病因的生殖道出血
注意事項
1.運動員慎用。
2.開始治療前,應對不孕的夫婦進行全面檢查,以排除妊娠禁忌症。當不能達到有效反應時,也應禁忌,例如:卵巢衰竭、生殖器官畸形所致的不孕症、子宮肌瘤所致的不孕症。另外,對甲狀腺功能低下、腎上腺皮質功能不全、高催乳素血症和垂體或下丘腦腫瘤的患者應進行評估,並給予相應的治療。
3.進行卵巢刺激的患者應考慮到可能出現雌激素的過度反應及多個卵泡發育,卵巢過度刺激的危險性增加。
4.卵巢過度刺激綜合症(OHSS)可能成為一個嚴重的不良反應,其特徵為易於破裂的卵巢大囊腫。過度的卵巢反應很少引起典型的過度刺激,除非以hCG誘導排卵。因此,在這種情況下應注意停止使用hCG並建議患者至少在4天內不要同房或使用工具避孕。
與自然受孕相比,進行誘導排卵的患者多胎妊娠及多胎出生的發生率增高。
建議在刺激治療前及治療過程中對患者,尤其是多囊卵巢患者的卵巢反應進行超聲監測。
並且為使OHSS和多胎妊娠的危險性降到最低,建議對患者進行超聲掃描及雌二醇檢測。對無排卵患者,當血清雌二醇水平>900pg/ml(3300pmol/L),且有3個以上卵泡直徑≥14mm時,患卵巢過度刺激綜合徵的危險性增加。
5.在臨床試驗中,本品可提高卵巢對促卵泡激素α 的敏感度。如果考慮增加FSH劑量,其遞增量最好為37.5IU-75IU,且劑量的調整最好在7-14天的間隔之後。
6.臨床試驗中未見對Luveris®高度敏感的報導。
7.未對Luveris®/FSH與人絕經期促性腺激素(hMG)進行過直接比較。數據表明,使用Luveris®/FSH的排卵率與使用hMG相似。
8.Luveris®不會影響患者駕駛和使用機器的能力。
2.開始治療前,應對不孕的夫婦進行全面檢查,以排除妊娠禁忌症。當不能達到有效反應時,也應禁忌,例如:卵巢衰竭、生殖器官畸形所致的不孕症、子宮肌瘤所致的不孕症。另外,對甲狀腺功能低下、腎上腺皮質功能不全、高催乳素血症和垂體或下丘腦腫瘤的患者應進行評估,並給予相應的治療。
3.進行卵巢刺激的患者應考慮到可能出現雌激素的過度反應及多個卵泡發育,卵巢過度刺激的危險性增加。
4.卵巢過度刺激綜合症(OHSS)可能成為一個嚴重的不良反應,其特徵為易於破裂的卵巢大囊腫。過度的卵巢反應很少引起典型的過度刺激,除非以hCG誘導排卵。因此,在這種情況下應注意停止使用hCG並建議患者至少在4天內不要同房或使用工具避孕。
與自然受孕相比,進行誘導排卵的患者多胎妊娠及多胎出生的發生率增高。
建議在刺激治療前及治療過程中對患者,尤其是多囊卵巢患者的卵巢反應進行超聲監測。
並且為使OHSS和多胎妊娠的危險性降到最低,建議對患者進行超聲掃描及雌二醇檢測。對無排卵患者,當血清雌二醇水平>900pg/ml(3300pmol/L),且有3個以上卵泡直徑≥14mm時,患卵巢過度刺激綜合徵的危險性增加。
5.在臨床試驗中,本品可提高卵巢對促卵泡激素α 的敏感度。如果考慮增加FSH劑量,其遞增量最好為37.5IU-75IU,且劑量的調整最好在7-14天的間隔之後。
6.臨床試驗中未見對Luveris®高度敏感的報導。
7.未對Luveris®/FSH與人絕經期促性腺激素(hMG)進行過直接比較。數據表明,使用Luveris®/FSH的排卵率與使用hMG相似。
8.Luveris®不會影響患者駕駛和使用機器的能力。
孕婦及哺乳期婦女用藥
不適用。
兒童用藥
不適用。
老年用藥
不適用。
藥物相互作用
除促卵泡激素α外,本品不可與其他藥物混合於同一針劑中注射。因己有研究表明,本品與促卵泡激素α同時使用,既不會改變活性物質、穩定性及藥代動力學也不會影響活性物質的藥效學特性。
除促卵泡激素α,本品不得與其它藥物混和。
除促卵泡激素α,本品不得與其它藥物混和。
藥物過量
尚不了解促黃體激素α過量的反應,然而,藥物過量可能產生卵巢過度剌激綜合徵,詳見“注意事項”。
在一項藥代動力學研究中,12名健康女性志願者接受了單次靜脈給予高達40000 IU的劑量,未出現嚴重不良反應。
在一項藥代動力學研究中,12名健康女性志願者接受了單次靜脈給予高達40000 IU的劑量,未出現嚴重不良反應。
臨床試驗
國外的臨床試驗
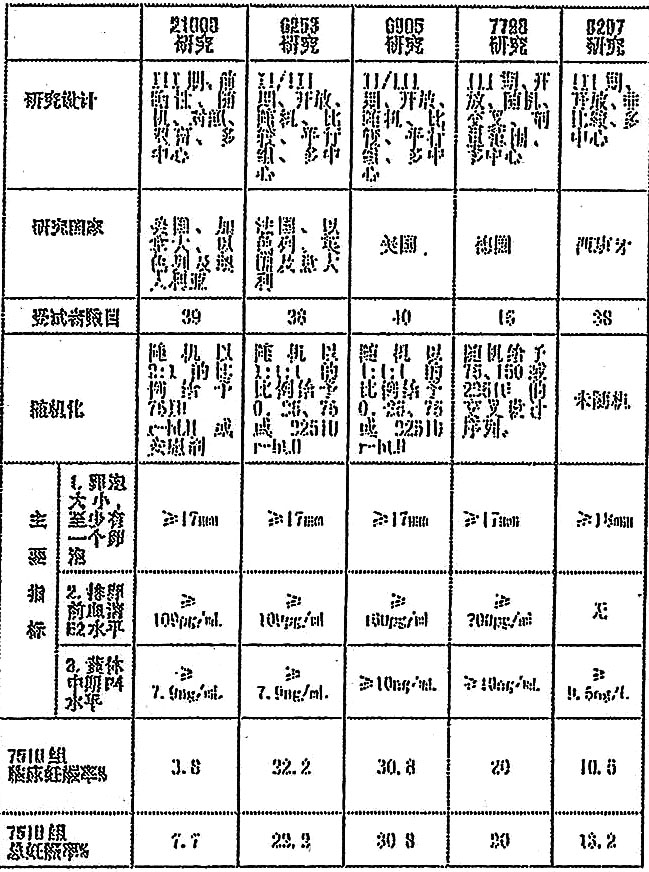
在國外共進行了五項臨床對照研究,以評價促黃體激素α 的有效性和安全性。具體研究情況見表1。
全部五項研究的主要療效指標為達到適當的卵泡發育,主要用三個標準界定:(i)卵泡大小。(ii)排卵前血清雌二醇(E2)水平及(iii)黃體中期(P4)水平。這三項標準與21008及6253研究的相同。8297研究沒有用第二項標準。每一項研究對卵泡發育的規定見表1。
用卵泡大小做標準是因為排卵前卵泡的大小己被確認。E2標準代表正常自然排卵周期的排卵前期E2水平的下限。P4水平的標準是正常自然排卵周期黃體中期己被確認血清P4的下限。因此,如果符合全部三項標準,卵泡發育及排卵會與受孕一致。因OHSS風險而終止治療及獲得妊娠的患者被計入卵泡發育成功之列,無論其是否符合卵泡發育標準。
這五項對照研究的數據包括總計170 例患者中的271個治療周期及107 例低 LH 患者(血清LH[l.2IU/L)中的152個治療周期。在這些研究中,計畫生育的154例患者中有48例妊娠及39例臨床妊娠。94例計畫生育的低 LH 患者中有22例妊娠及15例臨床妊娠。在低 LH 亞群及計畫懷孕的所有患者群體中按周期及按照患者計算的妊娠率及臨床妊娠率在75IU r-hLH 劑量組中最高。75IUr-hLH 治療組按患者計算的臨床妊娠率(28%)高於安慰劑組/0IU r-hLH 組(12.2%)且具有顯著的統計學意義(p=0.04)。
國內的臨床試驗
國內分別在6個臨床研究中心、共30例嚴重缺乏LH和FSH (低促性腺性性腺功能減退)的婦女中進行了一項多中心開放臨床研究,驗證每日皮下注射75IU 的重組人促黃體激素α 對低促性腺性性腺功能減退症的剌激作用和使用的安全性。
主要療效指標為達到適當的卵泡發育,主要用三個標準界定:
(i)至少有一個卵泡直徑大於17mm
(ii)注射 hCG 當天血清E2水平大於109pg/ml
(iii)因為擔心會發生卵巢過度剌激綜合徵而沒有注射 hCG 的受試者和妊娠的受試者
入組的31例患者在整個試驗過程中,均接受了治療劑量的藥物並完成了整個治療周期。在試驗過程中未出現不良事件,且在血常規、血生化和尿常規等實驗室檢查結果中,均未出現有臨床意義的異常變化。 在符合方案集的30例病例中, 23例達到療效指標, 9例達到臨床妊娠,有效率為76.7%,臨床妊娠率為30.0%。
表1 國外臨床研究概況
在國外共進行了五項臨床對照研究,以評價促黃體激素α 的有效性和安全性。具體研究情況見表1。
全部五項研究的主要療效指標為達到適當的卵泡發育,主要用三個標準界定:(i)卵泡大小。(ii)排卵前血清雌二醇(E2)水平及(iii)黃體中期(P4)水平。這三項標準與21008及6253研究的相同。8297研究沒有用第二項標準。每一項研究對卵泡發育的規定見表1。
用卵泡大小做標準是因為排卵前卵泡的大小己被確認。E2標準代表正常自然排卵周期的排卵前期E2水平的下限。P4水平的標準是正常自然排卵周期黃體中期己被確認血清P4的下限。因此,如果符合全部三項標準,卵泡發育及排卵會與受孕一致。因OHSS風險而終止治療及獲得妊娠的患者被計入卵泡發育成功之列,無論其是否符合卵泡發育標準。
這五項對照研究的數據包括總計170 例患者中的271個治療周期及107 例低 LH 患者(血清LH[l.2IU/L)中的152個治療周期。在這些研究中,計畫生育的154例患者中有48例妊娠及39例臨床妊娠。94例計畫生育的低 LH 患者中有22例妊娠及15例臨床妊娠。在低 LH 亞群及計畫懷孕的所有患者群體中按周期及按照患者計算的妊娠率及臨床妊娠率在75IU r-hLH 劑量組中最高。75IUr-hLH 治療組按患者計算的臨床妊娠率(28%)高於安慰劑組/0IU r-hLH 組(12.2%)且具有顯著的統計學意義(p=0.04)。
國內的臨床試驗
國內分別在6個臨床研究中心、共30例嚴重缺乏LH和FSH (低促性腺性性腺功能減退)的婦女中進行了一項多中心開放臨床研究,驗證每日皮下注射75IU 的重組人促黃體激素α 對低促性腺性性腺功能減退症的剌激作用和使用的安全性。
主要療效指標為達到適當的卵泡發育,主要用三個標準界定:
(i)至少有一個卵泡直徑大於17mm
(ii)注射 hCG 當天血清E2水平大於109pg/ml
(iii)因為擔心會發生卵巢過度剌激綜合徵而沒有注射 hCG 的受試者和妊娠的受試者
入組的31例患者在整個試驗過程中,均接受了治療劑量的藥物並完成了整個治療周期。在試驗過程中未出現不良事件,且在血常規、血生化和尿常規等實驗室檢查結果中,均未出現有臨床意義的異常變化。 在符合方案集的30例病例中, 23例達到療效指標, 9例達到臨床妊娠,有效率為76.7%,臨床妊娠率為30.0%。
表1 國外臨床研究概況

藥理毒理
藥理作用
重組人促黃體激素α(r-hLH)是採用基因工程技術獲得的一種糖蛋白,能與卵巢膜(及粒層)和辜丸間質細胞膜上的黃體素/絨毛膜促性腺激素(LH/CG)受體結合。在卵泡期,LH 剌激卵巢膜細胞分泌雄激素,可被粒層細胞用來合成雌二醇,以支持卵泡剌激素FSH 誘導的卵泡發育。在中期,高水平的LH 啟動黃體形成並且排卵。排卵後,LH 促進黃體產生黃體酮。對缺乏LH和FSH 不排卵的婦女,使用LH可促使卵泡分泌的雌二醇水平升高,剌激卵泡發育。
毒理研究
遺傳毒性:
Ames 試驗, V79 細胞6-TG 位點突變5 試驗人淋巴細胞染色體畸變試驗及小鼠骨髓微核試驗結果均為陰性。
生殖毒性:
一般生殖毒性:雌性大鼠交配前14 天至妊娠第7天皮下注射本品r-hLH 5、10 、20IU/kg, 高劑量組出現早期吸收和胎仔體重降低。致畸敏感期試驗: 妊娠大鼠或家兔皮下注射r-hLH 5、10 、20IU/kg,高劑量組出現早期吸收,中高劑量組胎仔出現頭部骨化不完全。F1 代發育及交配未見異常。圍產期毒性: 妊娠大鼠皮下注射r-hLH 5、10 、20IU/kg,出生率、存活率劑量依賴性降低。中高劑量組F1 代大鼠出現睪丸和卵巢較小;F1 代大鼠交配,胎仔出現多種異常。
重組人促黃體激素α(r-hLH)是採用基因工程技術獲得的一種糖蛋白,能與卵巢膜(及粒層)和辜丸間質細胞膜上的黃體素/絨毛膜促性腺激素(LH/CG)受體結合。在卵泡期,LH 剌激卵巢膜細胞分泌雄激素,可被粒層細胞用來合成雌二醇,以支持卵泡剌激素FSH 誘導的卵泡發育。在中期,高水平的LH 啟動黃體形成並且排卵。排卵後,LH 促進黃體產生黃體酮。對缺乏LH和FSH 不排卵的婦女,使用LH可促使卵泡分泌的雌二醇水平升高,剌激卵泡發育。
毒理研究
遺傳毒性:
Ames 試驗, V79 細胞6-TG 位點突變5 試驗人淋巴細胞染色體畸變試驗及小鼠骨髓微核試驗結果均為陰性。
生殖毒性:
一般生殖毒性:雌性大鼠交配前14 天至妊娠第7天皮下注射本品r-hLH 5、10 、20IU/kg, 高劑量組出現早期吸收和胎仔體重降低。致畸敏感期試驗: 妊娠大鼠或家兔皮下注射r-hLH 5、10 、20IU/kg,高劑量組出現早期吸收,中高劑量組胎仔出現頭部骨化不完全。F1 代發育及交配未見異常。圍產期毒性: 妊娠大鼠皮下注射r-hLH 5、10 、20IU/kg,出生率、存活率劑量依賴性降低。中高劑量組F1 代大鼠出現睪丸和卵巢較小;F1 代大鼠交配,胎仔出現多種異常。
藥代動力學
國外藥代動力學研究
對垂體不敏感的女性志願者給予75IU-40,000IU的促黃體激素α,其藥代動力學與尿源性的hLH相似。靜脈給藥後,促黃體激素α 以約為1 小時的起始半衰期迅速分布,從體內清除的終末半衰期約為10-12小時。穩態分布體積約為10-14L。促黃體激素α的藥代動力學曲線呈線型,以與劑量成正比的AUC 來評價。總清除率約為2L/h,小於5%的劑量從尿中排泄。平均保留時間約為5 小時。
150IU劑量皮下注射時,在無內源性LH的干擾下,其Cmax為1.1IU/L。絕對生物利用度約為60%,終末半衰期略有延長。單劑量及重複給予 Luveris®時,促黃體激素α 的藥代動力學是可比的且累積率很低。當同時給予促卵泡激素α時,二者的藥代動力學無相互影響。
國內藥代動力學研究
國內選擇75-225IU劑量在健康志願者中進行藥代動力學研究,分為75,150, 225IU三個劑量組。此研究結果顯示劑量低於225IU時血藥濃度、時間曲線下面
積與劑量沒有相關性。經3p97 計算軟體擬合計算,血藥濃度-時間曲線符合三室房室模型。藥物在血清中的Tmax 分別為0.64 ±1.35、0.50±0.70和0.37±0.59h;Cmax 分別為5.71±0.83、5.45±0.71和5.57±1.09mIU.mlˉ1;AUC(0-48)分別為230.52±33.91、225.81±32.84 和238.95±29.81 (mIU/ml) h。
對垂體不敏感的女性志願者給予75IU-40,000IU的促黃體激素α,其藥代動力學與尿源性的hLH相似。靜脈給藥後,促黃體激素α 以約為1 小時的起始半衰期迅速分布,從體內清除的終末半衰期約為10-12小時。穩態分布體積約為10-14L。促黃體激素α的藥代動力學曲線呈線型,以與劑量成正比的AUC 來評價。總清除率約為2L/h,小於5%的劑量從尿中排泄。平均保留時間約為5 小時。
150IU劑量皮下注射時,在無內源性LH的干擾下,其Cmax為1.1IU/L。絕對生物利用度約為60%,終末半衰期略有延長。單劑量及重複給予 Luveris®時,促黃體激素α 的藥代動力學是可比的且累積率很低。當同時給予促卵泡激素α時,二者的藥代動力學無相互影響。
國內藥代動力學研究
國內選擇75-225IU劑量在健康志願者中進行藥代動力學研究,分為75,150, 225IU三個劑量組。此研究結果顯示劑量低於225IU時血藥濃度、時間曲線下面
積與劑量沒有相關性。經3p97 計算軟體擬合計算,血藥濃度-時間曲線符合三室房室模型。藥物在血清中的Tmax 分別為0.64 ±1.35、0.50±0.70和0.37±0.59h;Cmax 分別為5.71±0.83、5.45±0.71和5.57±1.09mIU.mlˉ1;AUC(0-48)分別為230.52±33.91、225.81±32.84 和238.95±29.81 (mIU/ml) h。
貯藏
於原包裝中避光保存25℃以下,兒童不能觸及處。
包裝
一型玻璃瓶,橡膠塞密封,水晶有三種包裝規格,1,3,10瓶每盒(每盒中有相應數目的溶劑)。
有效期
36個月。
執行標準
JS20070125
批准文號
進口藥品註冊證號SZ00S0080
生產企業
瑞士雪蘭諾大藥廠
核准日期
2008年7月8日
