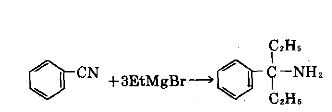試劑特點
格利雅試劑一般不單獨使用,而是將其溶於有機溶劑中使用。因為 它對空氣敏感,處理時,反應器必須用乾燥氮氣 置換。以RMgX表示,只是一種簡單的示意方 法,實際上格利雅試劑是由多種化合物形成的 一種平衡體系。這種平衡稱為許克倫平衡:2RMgX⇌R2Mg+MgX2
若溶劑的種類、格利雅試劑的濃度等發生變化時,化合物的組成情況也將改變,例如在鹼性較弱的乙醚溶液中,如果格利雅試劑濃度高,由於 試劑本身的締合而產生的二聚物(R2Mg2X2)較多;而在配位性強的四氫呋喃溶劑中,單聚物較多,格利雅試劑中含有極性很強的C—Mg鍵, 所以很活潑,能被許多含活潑氫的物質,如水、 醇、酸和氨等分解而放出烴,這是因為Mg的存在,R帶有負電性,可以和正離子結合,也可以和因極化而帶正電的分子的某一部分結合,所以含有活潑氫的物質中的氫就與R結合。格利雅試劑還可以和C=O、C≡N、C=S、S=O、 N=O等不飽和鍵發生加成作用,也可以和鹵化物作用。例如:RMgX+H—Y→YMgX+RH
式中:Y=鹵化物、OH、OR、SR、COOR、NH2、NHR、NR2、NHCOR、C≡CR等 。
格利雅試劑的套用
格利雅試劑的套用十分廣泛,重要的有:
①可以和許多含有活潑氫的化合物發生 劇烈反應而生成烴。
2RMgX+NH4Cl→ 2RH+Mg(NH2)X+MgXCl
酸、醇、酚、肟等均可發生上述反應,而製備烴。
②與有機鹵代物反應,生成碳原子較的烷烴(增長碳鏈)、環烷烴或不飽和烴。
RMgX+R′X→R—R′+MgX2
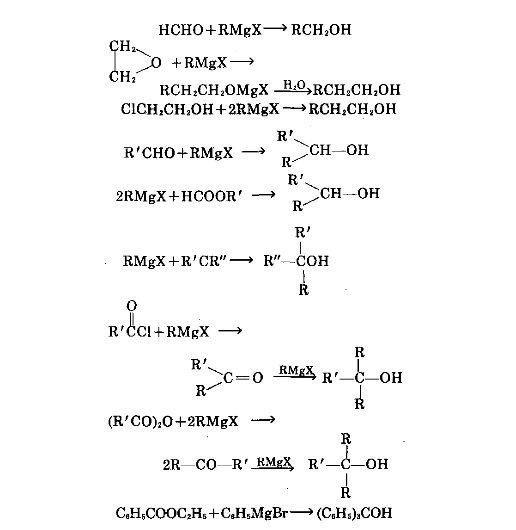
③與甲醛、環氧化物或鹵代醇反應可製得伯醇;與醛或甲酸酯反應可製得仲醇;與酮、酯、 醯氯及酸酐反應,可製得叔醇。
④製備羧酸及其酯。將二氧化碳導入格利 雅試劑中,可製得羧酸;用氯代酸酯與格利雅試 劑反應,可製得酯。
RMgX+CO2→RCCOH
ClCOOR′+RMgX→RCOOR′
⑤與原甲酸酯、甲醯胺、羧酸或腈等反應 可以製備醛或酮。
⑥含氮化合物與格利雅試劑反應,可製備胺。
CH3(CH2)4MgBr+CH3ONH2→ CH3(CH2)4NH2
⑦和腈反應,可製備叔胺。
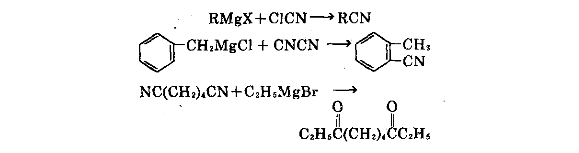
⑧與氯化腈或二腈反應,可製得腈。與己 二腈反應,然後水解,可製備二酮。
格利雅試劑還可用於有機矽化物、有機錫化物、有機磷化 物、有機硼化物等方面。以不對稱膦絡合物為催 化劑,利用格利雅試劑的偶合反應,可製得光活 性物質。還可用於高分子聚合時的催化劑。
製備方法
通常使金屬鎂與有機鹵代物在無水 乙醚中反應而製得格利雅試劑。
RX+Mg=RMgX
使用的原料和溶劑必須充分乾燥。有機鹵代物可以是脂肪族或芳香族等,根據鹵素的種類、反應是否容易,格利雅試劑收率高低而有所不同。 反應的難易主要取決於鹵代烴中烴的結構和鹵素的種類,若烴基相同,碘最容易反應,氯最難反應,但用碘時,易發生Wutz副反應而降低收 率。若鹵素相同,烴基愈大,反應愈難。有時為了 提高收率,儘可能要低鹵濃度下及低溫度下反應。
為了提高反應速度,在開始時加入少量碘來引發反應,一旦反應開始,因為反應是放熱的, 應迅速冷卻。也可用少量1,2-二溴乙烷代替 碘,特別是乙醚中有少量水時,採用此法更佳, 因為生成的溴化鎂有脫水作用。關於溶劑,可以 採用乙醚、丁基醚、四氫呋喃和苯甲醚等。溶劑不同,直接影響反應的難易和收率的高低,根據 H.Normant的研究,以四氫呋喃較合適,可使歷來感到困難的以氯乙烯、氯苯製取格利雅試劑變得很容易。這是因為氯乙烯與結合在烯碳 上的氯不能在乙醚中與鎂反應,但可在四氫呋 喃中反應,這樣製得的氯乙基鎂試劑,又稱為諾曼試劑。除四氫呋喃外,也可用2-甲基四氫呋喃為溶劑。
為了更好地啟動鎂與鹵代烴的反應,可用少量1,2-二溴乙烷代替碘,特別是乙醚中如有少量水時,二溴乙烷與鎂很快反應,生成溴化鎂和乙烯,溴化鎂有去水乾燥作用,新鮮的鎂與給定的鹵代烴就可反應生成需要的格利雅試劑,而不發生碘代烴的副反應。這種啟動反應叫做製備格利雅試劑的夾帶方法。
乙炔或其他端基炔烴與乙基格利雅試劑發生金屬化反應,得到乙烷和炔基鎂油狀不溶性物,後者可溶於四氫呋喃中,作格利雅試劑用。