基本介紹
- 中文名:核小體
- 外文名:nucleosome
- 直徑:11nm
- 高:6nm
- 構成:DNA和組蛋白(histone)
- 組成:H1(H5)、H2A、H2B、H3和H4
- 形狀:類似碟子或圓柱體
定義,染色體,實驗,原理,基本單位,臨床意義,注意事項,臨床意義,特性,檢測技術,研究進展,
定義
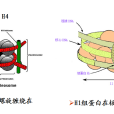
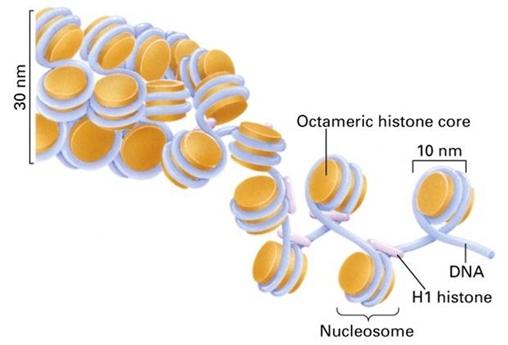
核小體是染色質的基本結構單位,由DNA和H1、H2A、H2B、H3和H4等5種組蛋白(histone,H)構成。兩分子的H2A、H2B、H3和H4形成一個組蛋白八聚體,約200 bp的DNA分子盤繞在組蛋白八聚體構成的核心結構外面1.75圈形成了一個核小體的核心顆粒(core particle)。核小體的核心顆粒再由DNA(約60bp)和組蛋白H1共同構成的連線區連線起來形成串珠狀的染色質細絲。這時染色質的壓縮檔裝 比(packing ratio)為6左右,即DNA由伸展狀態壓縮了近6倍。200 bpDNA為平均長度;不同組織、不同類型的細胞,以及同一細胞里染色體的不同區段中,盤繞在組蛋白八聚體核心外面的DNA長度是不同的。如真菌的可以短到只有154 bp,而海膽精子的可以長達260bp,但一般的變動範圍在180bp到200bp之間。在這 200bp中,146 bp是直接盤繞在組蛋白八聚體核心外面,這些DNA不易被核酸酶消化,其餘的DNA是用於連線下一個核小體。連線相鄰2個核小體的DNA分子上結合了另一種組蛋白H1。組蛋白H1包含了一組密切相關的蛋白質,其數量相當於核心組蛋白的一半,所以很容易從染色質中抽提出來。所有的H1被除去後 也不會影響到核小體的結構,這表明H1是位於蛋白質核心之外的。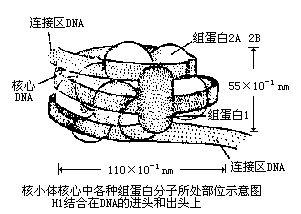

染色體
染色體是一個獨立行動的結構單位,在細胞分裂時傳遞給子細胞一份染色體拷貝。因此每條染色體必須能複製,所複製的拷貝最後分離並被正確地分配到兩個子細胞中。這些基本功能是由真核生物染色體三種特定的DNA序列所控制,即DNA複製起點、著絲粒和端粒。
從DNA到染色體不論是形態還是長度都相差很大。人類最長的一個染色體全長僅10μm,但其DNA卻長達7.2cm;一個細胞核直徑僅5μm,在這樣一個小小的空間中卻要納下全長近200cm的DNA,人們不禁要問DNA如何形成染色體,納入小小的核中。解決這個問題同樣是由很多科學家差不多經過20年的努力,最終提出了為大多數能接受的模型¾側環模型。
實驗
早在1956年為雙螺旋模型提供X衍射證據的Wilkins和另一位科學家Vittorio Luzzati對染色質進行了X衍射研究,發現染色質中具有間隔為10 nm的重複性結構。蛋白質和DNA本身的結構從來不會表現出這種重複性。推測可能是組蛋白和DNA的結合方式迫使DNA摺疊或纏繞成具有10 nm周期的重複結構。 DNA雙螺旋模型
DNA雙螺旋模型
 DNA雙螺旋模型
DNA雙螺旋模型Clark和Felsenfeld於1971年首先用葡萄球菌核酸酶(Staphylococcal nuclease)來作用於染色質,發現有一些區域對核酸酶敏感,有一些則不敏感,不敏感的區域比較均一,這暗示染色體中存在著某些亞單位。接著Hewish和Burgoyun(1973年)用內源核酸酶消化細胞核,再從核中分離出DNA,結果發現一系列DNA片段,它們相當於長約200bp的一種基本單位的多聚體。表明組蛋白結合在DNA,以一種有規律的方式分布,以致產生對核酸酶敏感的只是某些限定區域。M.Noll(1974年)用外源核酸酶處理染色質,然後進行電泳,證實了以上結果,他測得前三個片段的長度分別為205,405,605bp長,每個片段相差200bp,即染色質可能以200bp為一個單位。這正好和以下電鏡觀察的結果相映證。
與此同時Olins夫婦(1974)和Pierre Chambon等(1975)在電鏡下觀察到大鼠胸腺和雞肝染色質的“繩珠”狀結構,小球的直徑為10 nm;,Olins並把這種小球稱為n小體(n-body即nu body),有時譯成鈕體。
電泳的結果和電鏡觀察到“繩珠”結構之間是什麼樣的關係呢?Kornberg和Thomas 1974年用實驗回答了這一問題。他們先用小球菌核酸酶稍稍消化一下染色質,切斷一部分200核苷酸對單位之間的DNA,使其中含有單體、二聚體、三聚體和四聚體等。然後經離心將它們分開。每一組再通過凝膠電泳證明其分子大小及純度。然後分別用電鏡來觀察各組的材料;結果單體均為一個10 nm的小體,二聚體則是兩個相聯的小體,同樣三聚體和四聚體分別由三個小體和四個小體組成,表明200核苷酸的電泳片段長度級差正好是電鏡觀察到的一個:“繩珠”單位,他們稱其為核小體(nucleosome)或核粒,提出了染色質結構的“繩珠”模型。
原理
人們接著用化學交聯、高鹽分離組蛋白,以及X衍射等方法進一步研究組蛋白多聚體的結構、排列以及怎樣和DNA結合的,從而建立了核小體模型。1984年Klug和Butler進行了修正。核小體的構造可用圖表示:每一個核小體結合的DNA總量為200bp左右,一般在150~250變化範圍(micrococcal nuclease)輕微消解染色質而得知的。連線兩個核小體的連線DNA (linker DNA) 是最容易受到這種酶的作用,因此微球菌核酸酶在連線DNA處被切斷,此時每個重複單位的DNA長約200bp,而且是和五種組蛋白相結合,保持著核小體的結構。也就是“繩珠”結構的繩被切斷,剩下一個一個的“珠”。 核小體
核小體
 核小體
核小體基本單位
生物學意義
揭示了DNA作為遺傳物質穩定性的結構特徵;確認了鹼基互補配對原則。
臨床意義
抗核小體抗體比抗dsDNA抗體、抗組蛋白抗體更早出現於系統性紅斑狼瘡的早期,並且特異性較高。陽性率為50-90%,特異性>98%。每個核小體單位包括200bp左右的DNA超螺旋和一個組蛋白八聚體及一個分子H1;組蛋白八聚體構成核小體的盤狀核心結構;146bp的DNA分子超螺旋盤繞組蛋白八聚體1.75圈,組蛋白H1在核心顆粒外結合額外20bp DNA,鎖住核小體DNA的進出端,起穩定核小體的作用。包括組蛋白H1和166bp DNA的核小體結構又稱染色質小體;兩個相鄰核小體之間以連線DNA相連,典型長度60bp,不同物種變化值為0~80bp;組蛋白與DNA之間的相互作用主要是結構性的,基本不依賴於核苷酸的特異序列,實驗表明,核小體具有自組裝 (self-assemble) 的性質;核小體沿DNA的定位受不同因素的影響,進而通過核小體相位改變影響基因表達。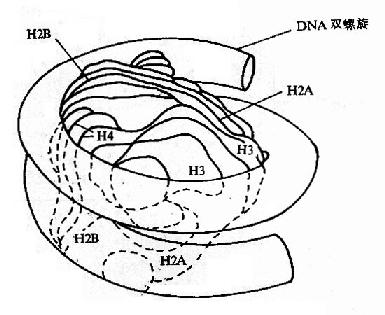 核小體
核小體
 核小體
核小體其功能與染色質的濃縮有關,且能夠進行自裝配。
注意事項
AnuA被定義為與組織蛋白暴露在染色質的部分發生反應的抗體,在染色質內找到的DNA結構,或者一個由天然組織蛋白?DNA複合物構成的表位,特別要排除的是抗體與非組織蛋白的反應和隱藏在染色質內的組織蛋白表位的反應,以及與DNA結構如A、C以及Z構型的反應。這些在染色質中均不存在,因此,並不是所有組織蛋白和DNA活性的抗體都具有抗?染色質活性。染色質作為ELISA中的抗原最有用的構型是脫H1染色質和核小體核心粒子。在這兩種情況下,天然染色質通過微球菌核酸酶消化溶解,H1和非組織蛋白被除去,再用0.5M生理鹽水在中性pH條件下而得染色質。核小體核心粒子由包裹在天然組織蛋白(H2A、H2B、H3、H4)八聚體DNA組成。多元核小體核心粒子,DNA鏈未被核酸酶切斷時,叫做H1?修飾染色質。人們開始重新關注AnuA。AnuA是首批被發現的自身抗體之一,因為它們是組成引起紅斑狼瘡的細胞排列構造的大多數抗體。許多研究資料表明了這種抗體輔助診斷系統性紅斑狼瘡和藥物引起的狼瘡(DIL)的臨床套用,並且從某種意義上來說,AnuA的定量曾是在臨床實驗室所進行的最普遍的免疫學實驗之一。AnuA在過去的10年裡曾有過許多的名字:紅斑狼瘡因子、抗核小體、抗DNP以及抗?(H2A?H2B?DNA),這些自身抗體可在近乎75%的系統性紅斑狼瘡患者身上找到,並且有達100%的患者是由藥物引起的,它們也可在20%~50%的1型自身免疫型肝炎患者身上找到。
臨床意義
在80%的MRL/lprDIL小鼠中可產生核小體特異性抗體,該自身抗體產生早,先於其他抗核抗體,與腎小球腎炎有關。SLE患者多克隆核小體特異性自身抗體的抗原反應與鼠類SLE模型表現相似,核小體在SLE中作為主要自身抗原已得到證實。靶器官中免疫複合物的沉積和炎性介質(包括補體)的大量活化是引起SLE全身性組織炎症損傷的基本機制之一。核小體會成為多克隆B細胞活化劑,這可能與SLE疾病的起始階段有關;但更重要的是,核小體是SLE中致病性T輔助細胞識別的自身抗原,不僅引起同源B細胞產生核小體特異性自身抗體,而且引起抗DNA抗體和抗組蛋白抗體的形成。AnuA在抗ds?DNA陰性的SLE患者中有很高的陽性率(可達60%~65%)[8,16],因此AnuA對SLE患者更具有診斷價值。已經有證據表明,除了傳統的致病性抗雙鏈DNA抗體及其抗原抗體複合物外,核小體和組蛋白成分的自身抗體及其抗原抗體複合物,在SLE的發病機制中起關鍵作用,尤其是在DIL腎炎致病機制上意義重大[6]。核小體的組蛋白成分(氨基末端帶強陽性電荷)可促進免疫複合物與腎小球基底膜陰離子位點的結合,包括既作為植入抗原使原位免疫複合物得以形成,也可使含有核小體特異性抗體的循環免疫複合物得以沉積。在以上兩種情況下,均可使腎小球基底膜的通透性增加,且產生炎性免疫應答反應。鐘清等[7]研究表明,LN組患者AnuA陽性率明顯高於無腎炎組,AnuA對LN的診斷和監測具有重要意義。此外,蘇茵等[8]也發現AnuA與患者的皮疹、脫髮、ESR增快、CRP增高、補體降低呈顯著相關性,其滴度高低也與SLE疾病活動指數評分呈明顯正相關。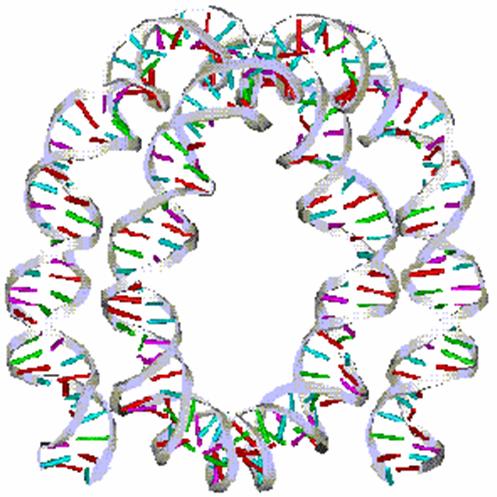 核小體
核小體
 核小體
核小體特性
有兩項關於AnuA重要評論表明這種抗體對SLE和DIL具有敏感性和特異性,並且AnuA的存在通常在SLE與腎小球腎炎患者中相聯繫。AnuA較抗DNA具有更高的敏感性。如果陰陽性分割點升高,能使抗核小體對狼瘡更加敏感。由於核小體抗原純化技術的改進,提高了AnuA對SLE患者的診斷特異性。研究結果表明,套用ELISA方法檢測AnuA在SLE患者中具有很高的敏感性和特異性。國外報導,對SLE患者進行AnuA檢測,起敏感性和特異性分別為56.0%~64.2%和97.0%~98.8%,國內蘇茵等提出,AnuA可出現於SLE疾病進程的各個時期,對SLE的敏感性高(69.9%)、特異性強(97.9%),可能是SLE的標記抗體之一,但許苛等,報導測定敏感性偏低(55.8%)、特異性偏低(95.3%)。考慮與AnuA的來源不同、檢測人群和疾病活動度不同以及所用實際不同有關,但是與dsDNA抗體、抗Sm抗體比較,敏感性均有了較大的提高,且有良好的特異性,可用於SLE的診斷,多種商品化檢測試劑盒的出現,使該自身抗體套用於臨床SLE等結締組織病的診斷和鑑別診斷成為可能。
檢測技術
許多不同的技術已被用於檢測AnuA,除了LE細胞試驗以外,還有染色質包被的串珠乳膠凝集試驗,以及免疫沉澱(用天然組織蛋白重組酸萃取的組織部分和ELISA法都已被使用。早期的研究用“脫氧核苷蛋白”作抗原研製出一種孵育在1M生理鹽水中的染色質中的預備品,但未得到明確鑑定。後期報導已有更好的方法來鑑定該預備品,並能分析凝膠電泳後的蛋白質和DNA的組成。染色質的類型分析以及陰、陽性判斷對於輔助診斷SLE患者而獲取高敏感性和特異性是非常重要的。第一種研究用於以變性的H2A和H2B作為抗原進行DNA再造,由血清結合上組織蛋白的變性區域,即天然染色質非暴露部分;第二種研究用於整條染色質作為抗原,剩餘的Scl70蛋白引起抗Scl70,血清在此情況下產生弱陽性;第三種研究用於一個陰、陽性的弱的(低的)判斷(硬皮患者血清呈現弱陽性)。第一代與第二代核小體檢測技術的比較通過對SLE組(96例)、患者對照組(73例)、正常對照組(47例)進行AnuA和抗dsDNA抗體的檢測,採用由德國EUROIMMUN公司生產的試劑盒和美國Coda公司生產的全自動酶標分析儀檢測。結果表明,EUROIMMUN推出的第二代抗核小體抗體ELISA檢測試劑與第一代比較敏感度差異不大,但特異性卻有了明顯提高。早期因核小體抗原純化製備方法存在技術上的問題,純化的核小體抗原常含有H1、Scl70(DNA拓撲異構酶I,一種DNA結合蛋白)、殘留的染色質DNA和其他非組蛋白等蛋白成分,導致多種結締組織病患者血清與核小體抗原交叉反應,尤其是在10%~68%的硬皮病患者中也可檢測出AnuA,使得該抗體作為SLE特異性抗體的臨床套用價值得到了很大的限制;而第二代AnuAELISA試劑在抗原的製備上有了很大的改進,抗原分離純化技術提高,純化的核小體抗原製品只含核小體單體,不含以上提到的DNA和組蛋白等雜質成分,可排除硬皮病患者血清假陽性反應,這樣就使得AnuA對SLE的診斷價值得到了充分的發揮,極大提高了AnuA對SLE的特異性,已開始套用於臨床常規檢測。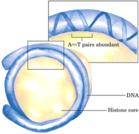 核小體
核小體
 核小體
核小體研究進展
國內已有少數醫院開展了AnuA的檢測,也已發表了數篇相關報導。有文獻報導,以核小體多肽特異性抗原治療鼠狼瘡模型的研究發現,核小體多肽特異性抗原可以抑制TH細胞和B細胞的激活,從而為研究SLE的發病機制治療帶來了新的曙光[20]。但需要指出的是:AnuA的檢測對SLE的診斷有重要意義,不同的核小體來源、不同的檢測人群和疾病活動度、以及檢測試劑、方法等均會帶來結果差異。該抗體與抗Sm抗體不同,並非是SLE標記抗體。雖然已發現AnuA對診斷SLE的敏感性和特異性比抗dsDNA抗體高,但仍有不完全一致的結果。中國的情況如何還應進行大樣本、多中心檢測從而得到更合理、更準確的結論。SLE的診斷不能僅憑某一種抗體陽性與否加以肯定或否定,在建立該抗體檢測前首先要明確其臨床意義,其次,要避免假陽性或假陰性結果,如同其他自身抗體的檢測一樣,臨床醫師在診治工作中必須密切結合患者的臨床資料,正確看待檢測結果,切勿以實驗室檢查代替一切。
 核小體
核小體