枸地氯雷他定片,適應症為本品用於緩解慢性特發性蕁麻疹及常年性過敏性鼻炎的全身及局部症狀。
基本介紹
- 藥品名稱:枸地氯雷他定片
- 藥品類型:處方藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,
成份
本品主要成份為枸地氯雷他定。其化學名稱為:8-氯-6,11-二氫-11-(4-氮己環叉)-5H-苯-[5,6]環庚[1,2-b]吡啶枸緣酸氫二鈉鹽二水合物。
化學結構式:
分子式:C25H25ClN2O7Na2.H2O
分子量:582.92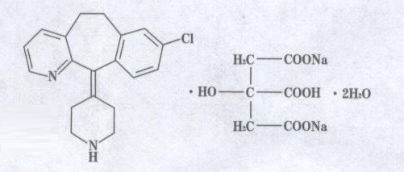
化學結構式:
分子式:C25H25ClN2O7Na2.H2O
分子量:582.92

性狀
本品為薄膜衣片,除去包衣後顯白色或類白色。
適應症
本品用於緩解慢性特發性蕁麻疹及常年性過敏性鼻炎的全身及局部症狀。
規格
8.8mg(按C25H25ClN2O7Na2計)。
用法用量
成人及12歲以上的青少年:口服,每日一次,每次一片。
不良反應
本品主要不良反應為口乾、嗜睡、睏倦、乏力等。
本品在體內快速轉化為地氯雷他定,文獻報導地氯雷他定的不良反應為噁心、頭暈、頭痛、睏倦、口乾、乏力,偶見嗜睡、健忘及晨起面部、肢端水腫。
在一系列以季節性過敏性鼻炎和慢性特發性蕁麻疹為適應症的臨床試驗中,患者按每天5患毫克的推薦劑量服用地氯雷他定,試驗組不良反應發生率比安慰劑組高3%。超過安慰劑組的最常見不良反應為疲倦(1.2%)、口乾(0.8%)和頭痛(0.6%)。
在地氯雷他定上市後罕有過敏性反應報導,包括過敏和皮疹。另外罕有心動過速、心悸、肝酶升高及膽紅素增加的報導。
本品在體內快速轉化為地氯雷他定,文獻報導地氯雷他定的不良反應為噁心、頭暈、頭痛、睏倦、口乾、乏力,偶見嗜睡、健忘及晨起面部、肢端水腫。
在一系列以季節性過敏性鼻炎和慢性特發性蕁麻疹為適應症的臨床試驗中,患者按每天5患毫克的推薦劑量服用地氯雷他定,試驗組不良反應發生率比安慰劑組高3%。超過安慰劑組的最常見不良反應為疲倦(1.2%)、口乾(0.8%)和頭痛(0.6%)。
在地氯雷他定上市後罕有過敏性反應報導,包括過敏和皮疹。另外罕有心動過速、心悸、肝酶升高及膽紅素增加的報導。
禁忌
對本產品活性成分或賦形劑過敏者禁用。
注意事項
1、由於抗組胺藥能清除或減輕皮膚對所有變應原的陽性反應,因而在進行任何皮膚過敏性試 驗前48小時,應停止使用本品。
2、肝功能不良、膀胱經阻塞或尿瀦留、尿道張力過強、前列腺肥大、青光眼患者應遵醫囑用藥。
3、若發生嗜睡或頭暈,請避免開車和操作機器。
4、嚴重腎功能不全者慎用。
2、肝功能不良、膀胱經阻塞或尿瀦留、尿道張力過強、前列腺肥大、青光眼患者應遵醫囑用藥。
3、若發生嗜睡或頭暈,請避免開車和操作機器。
4、嚴重腎功能不全者慎用。
孕婦及哺乳期婦女用藥
由於尚無孕婦使用枸地氯雷他定的臨床資料,懷孕期內使用枸地氯雷他定的安全性尚未確定,除非潛在的益處超過可能的風險,懷孕期內不應使用枸地氯雷他定。
地氯雷他定可經過乳汁排泌,因此不建議哺乳期婦女使用枸地氯雷他定。
地氯雷他定可經過乳汁排泌,因此不建議哺乳期婦女使用枸地氯雷他定。
兒童用藥
枸地氯雷他定對12歲以下兒童患者的療效和安全性尚未確定。
老年用藥
未進行該項實驗且無可靠參考文獻。
藥物相互作用
未進行枸地氯雷他定相關試驗。本品在體內快速轉化為地氯雷他定,地氯雷他定相關文獻資料報導中,地氯雷他定臨床試驗中未發現地氯雷他定存在有臨床相關意義的相互作用。地氯雷他定在與阿奇黴素、酮康唑、紅黴素、氟西汀和西咪替丁的多劑量藥物相互作用試驗中,血漿濃度未出現有臨床相關意義的改變。然而,地氯雷他定的代謝酶尚未確定,因此與其他藥物的相互作用尚不能完全排除。
地氯雷他定與其他抗交感神經藥或有中樞神經系統鎮靜作用的藥合用會增強睡眠。
進食或飲用葡萄柚汁對地氯雷他定的分布沒有影響。
地氯雷他定與酒精同時使用時不會加強酒精對人行為能力的損害作用。
地氯雷他定與其他抗交感神經藥或有中樞神經系統鎮靜作用的藥合用會增強睡眠。
進食或飲用葡萄柚汁對地氯雷他定的分布沒有影響。
地氯雷他定與酒精同時使用時不會加強酒精對人行為能力的損害作用。
藥物過量
未進行本品活性成分相關試驗。本品在體內快速代謝轉化為地氯雷他定,有文獻報導地氯雷他定相關資料。
服藥過量時,應考慮採取標準治療措施去除未吸收的活性成分。建議進行對症及支持治療。
在一項對成人和青少年進行的多劑量臨床試驗中,受試者接受高達45mg的地氯雷他定(臨床實際用量的9倍),臨床上未觀察到不良反應的發生,但有使心電圖Q-Tc間期延長的可能。
地氯雷他定不能通過血液透析排除,是否可以通過腹膜透析排除尚不確定。
服藥過量時,應考慮採取標準治療措施去除未吸收的活性成分。建議進行對症及支持治療。
在一項對成人和青少年進行的多劑量臨床試驗中,受試者接受高達45mg的地氯雷他定(臨床實際用量的9倍),臨床上未觀察到不良反應的發生,但有使心電圖Q-Tc間期延長的可能。
地氯雷他定不能通過血液透析排除,是否可以通過腹膜透析排除尚不確定。
藥理毒理
藥理作用
枸地氯雷他定在體內轉化為地氯雷他定發揮作用。
地氯雷他定為非鎮靜性的長效三環類抗組胺藥,為氯雷他定的活性代謝物,可通過選擇性地拮抗外周H1 受體,緩解季節性過敏性鼻炎或慢性特發性蕁麻疹的相關症狀。另外,體外研究結果,地氯雷他定可抑制組胺從人肥大細胞釋放。動物研究顯示,地氯雷他定不易通過血腦屏障。
枸地氯雷他定未進行相應的毒理研究。以下是地氯雷他定的毒理研究結果。
毒理研究:
急性毒性:大鼠經口給藥劑量達250mg/kg時出現死亡(按AUC計算,地氯雷他定及其代謝產物的暴露量約為臨床推薦日口服劑量的120倍),小鼠經口給藥LD50為353mg/kg(按體表面積計算,地氯雷他定約為臨床推薦劑量的290倍)。猴經口給藥劑量達250mg/kg(按體表面積計算,地氯雷他定約為臨床推薦劑量的810倍)時,未出現死亡。。
遺傳毒性:在回復突變試驗(沙門氏菌/大腸桿菌哺乳動物微粒體細菌基因突變試驗)和染色體畸變試驗(人外周血淋巴細胞誘裂性試驗和小鼠骨髓微核試驗)中,未見本品有潛在的遺傳毒性。
生殖毒性:本品經口給藥劑量達24mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的130倍)時,對雌性大鼠生育力無影響;經口給藥劑量達12mg/kg/日(地氯雷他定的暴露量約為臨床日推薦口服劑量下AUC45倍)時,出現雌鼠受孕率下降、雄鼠精子數減少、精子活力降低和睪丸組織學改變,表明雄性大鼠生育力降低;經口給藥劑量為3mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的8倍)時,對大鼠生育力無影響。
大鼠和家兔經口給予本品,劑量分別達48和60mg/kg/日(地氯雷他定達到及其代謝物的暴露量分別約為臨床日推薦口服劑量下AUC的210和230倍)時,未見致畸作用。雌性大鼠給藥劑量為24mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的120倍)時,可見植入前丟失率增加、植入數和胚胎數減少;給藥劑量為9mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的50倍)或以上時,可見仔鼠體重減輕和翻正反射減慢;給藥劑量為3mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的7倍)時,本品對仔鼠發育無影響。但目前尚無充分的和嚴格對照的孕婦臨床研究資料,因為動物生殖試驗並不總能預測人的反應,除非確實需要,在懷孕期限間不應使用本品。本品可通過乳汁分泌,因此應根據該藥對母親的重要性決定是否停止哺乳或停藥。
致癌性:通過氯雷他定的研究對本品的潛在致癌性進行了評估。小鼠和大鼠分別連續經口給予氯雷他定18個月和2年,雄性小鼠給藥劑量達40mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的3倍)時,肝細胞瘤(包括腺瘤和癌)的發生率明顯高於對照組。雄性大鼠給藥劑量為10mg/kg/日,雌性和雄性大鼠給藥劑量為25mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的7和30倍)時,肝細胞瘤發生率顯著升高。以上發現與地氯雷他定長期給藥的臨床相關性尚不明確。
枸地氯雷他定在體內轉化為地氯雷他定發揮作用。
地氯雷他定為非鎮靜性的長效三環類抗組胺藥,為氯雷他定的活性代謝物,可通過選擇性地拮抗外周H1 受體,緩解季節性過敏性鼻炎或慢性特發性蕁麻疹的相關症狀。另外,體外研究結果,地氯雷他定可抑制組胺從人肥大細胞釋放。動物研究顯示,地氯雷他定不易通過血腦屏障。
枸地氯雷他定未進行相應的毒理研究。以下是地氯雷他定的毒理研究結果。
毒理研究:
急性毒性:大鼠經口給藥劑量達250mg/kg時出現死亡(按AUC計算,地氯雷他定及其代謝產物的暴露量約為臨床推薦日口服劑量的120倍),小鼠經口給藥LD50為353mg/kg(按體表面積計算,地氯雷他定約為臨床推薦劑量的290倍)。猴經口給藥劑量達250mg/kg(按體表面積計算,地氯雷他定約為臨床推薦劑量的810倍)時,未出現死亡。。
遺傳毒性:在回復突變試驗(沙門氏菌/大腸桿菌哺乳動物微粒體細菌基因突變試驗)和染色體畸變試驗(人外周血淋巴細胞誘裂性試驗和小鼠骨髓微核試驗)中,未見本品有潛在的遺傳毒性。
生殖毒性:本品經口給藥劑量達24mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的130倍)時,對雌性大鼠生育力無影響;經口給藥劑量達12mg/kg/日(地氯雷他定的暴露量約為臨床日推薦口服劑量下AUC45倍)時,出現雌鼠受孕率下降、雄鼠精子數減少、精子活力降低和睪丸組織學改變,表明雄性大鼠生育力降低;經口給藥劑量為3mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的8倍)時,對大鼠生育力無影響。
大鼠和家兔經口給予本品,劑量分別達48和60mg/kg/日(地氯雷他定達到及其代謝物的暴露量分別約為臨床日推薦口服劑量下AUC的210和230倍)時,未見致畸作用。雌性大鼠給藥劑量為24mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的120倍)時,可見植入前丟失率增加、植入數和胚胎數減少;給藥劑量為9mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的50倍)或以上時,可見仔鼠體重減輕和翻正反射減慢;給藥劑量為3mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的7倍)時,本品對仔鼠發育無影響。但目前尚無充分的和嚴格對照的孕婦臨床研究資料,因為動物生殖試驗並不總能預測人的反應,除非確實需要,在懷孕期限間不應使用本品。本品可通過乳汁分泌,因此應根據該藥對母親的重要性決定是否停止哺乳或停藥。
致癌性:通過氯雷他定的研究對本品的潛在致癌性進行了評估。小鼠和大鼠分別連續經口給予氯雷他定18個月和2年,雄性小鼠給藥劑量達40mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的3倍)時,肝細胞瘤(包括腺瘤和癌)的發生率明顯高於對照組。雄性大鼠給藥劑量為10mg/kg/日,雌性和雄性大鼠給藥劑量為25mg/kg/日(地氯雷他定及其代謝物的暴露量約為臨床日推薦口服劑量下AUC的7和30倍)時,肝細胞瘤發生率顯著升高。以上發現與地氯雷他定長期給藥的臨床相關性尚不明確。
藥代動力學
在I期臨床試驗中,男女各5名健康志願者口服本品,每日一次,每次一片。其藥代動力學參數如下,Cmax分別為3.172±0.648ng/mL和3.167±0.398ng/mL,Tmax分別為2.5±0.3h和2.7±0.2h,Ka分別為0.486±0.085h-1和0.518±0.097h-1,T1/2α分別為2.60±0.41h和3.50±0.90h,T1/2β分別為26.70±3.03h和23.58±3.04h,MRT分別為27.48±1.83h和27.47±0.67h,AUC0-72分別為46.23±6.60ng·h/mL和49.30±6.34ng·h/mL,AUC0-∞分別為50.74±6.66ng·h/mL和53.81±6.06ng·h/mL。男性和女性健康志願者的藥代動力學參數相近。
貯藏
密封,在乾燥處保存。
包裝
鋁塑包裝,6片/板,1板/盒,3片/板,1板/盒。
有效期
24個月
執行標準
國家食品藥品監督管理局標準TBH3132009
