捷佰舒® (注射用奈達鉑),適應症為主要用於頭頸部癌、小細胞肺癌、非小細胞肺癌、食管癌等實體瘤。
基本介紹
- 藥品名稱:捷佰舒
- 藥品類型:處方藥、醫保工傷用藥
- 用途分類:細胞毒性藥物
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,批准文號,生產企業,核准日期,修訂日期,
成份
本品主要成份為奈達鉑,
其化學名稱為:順-二氨基甘醇酸鉑。
化學結構式:
其化學名稱為:順-二氨基甘醇酸鉑。
化學結構式:
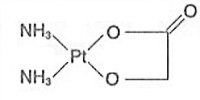
分子式:C2H8N2O3Pt
分子量:303.18
輔料名稱:右旋糖酐40.
性狀
本品為類白色或微黃色疏鬆塊狀物或粉末。
適應症
主要用於頭頸部癌、小細胞肺癌、非小細胞肺癌、食管癌等實體瘤。
規格
10mg
用法用量
臨用前,用0.9%氯化鈉注射液溶解後,再稀釋至500ml,靜脈滴注,滴注時間不應少於1小時,滴完後需繼續點滴輸液1000ml以上。推薦劑量為每次給藥80-100mg/㎡,每療程給藥一次,間隔3-4周后方可進行下一療程。
不良反應
本品主要不良反應為骨髓抑制,表現為白細胞、血小板、血色素減少;其它較常見的不良反應包括噁心、嘔吐、食欲不振等消化道症狀以及肝腎功能異常、耳神經毒性、脫髮等。其它不良反應雖發生率較低,但應引起關註:
1.嚴重不良反應:
(1) 過敏性休克症狀 (0.1%-5%):出現過敏性休克症狀(潮紅、呼吸困難、畏寒、血壓下降等),應細心觀察,發現異常應立即停藥並做適當的處理。
(2) 骨髓抑制 (頻度不明):表現為紅細胞減少、貧血、白細胞減少、中性粒細胞減少、血小板減少、出血傾向 (0.1-5%),應細心觀察末稍血象,發現異常,應延長給藥間隔、減量或停藥並進行適當的處理。
(3) 腎功能異常 (0.1%-5%):出現血尿素氮、血肌酐升高,肌酐清除率下降,β2球蛋白升高,以及血尿、蛋白尿、少尿、代償性酸中毒及尿酸升高等,發現異常,對於是否繼續給藥,應慎重檢查。
(4) 阿-斯綜合症 (Adams-Stokes Syndrome)發作:有報導因使用本品引起阿-斯綜合症而死亡的病例 (參照:注意事項12)。
(5) 聽覺障礙、聽力低下、耳鳴 (頻度不明):本品可引起耳神經系統毒性反應,表現為聽覺障礙、聽力低下、耳鳴。用藥期間應進行適當的聽力檢查並觀察患者的狀態,發現異常應停藥並做適當的處理;治療前用過其它鉑類製劑的、給藥前就有聽力低下、腎功能低下的患者應特別注意。
(6) 間質性肺炎 (頻度不明):對於伴有發熱、咳嗽、呼吸困難、胸部X線異常的間質性肺炎患者,應細心觀察,發現異常應終止給藥,並給予腎上腺皮質激素等藥物進行適當的處理。
(7) 抗利尿激素分泌異常綜合症 (SIADH)(頻度不明):表現為低鈉血症,低滲透壓血症,尿中鈉離子排泄增加,伴有高張尿、意識障礙等,發現這些症狀應終止給藥,並採取限制水分攝取等適當的方法處理。
2.其他不良反應:
1.嚴重不良反應:
(1) 過敏性休克症狀 (0.1%-5%):出現過敏性休克症狀(潮紅、呼吸困難、畏寒、血壓下降等),應細心觀察,發現異常應立即停藥並做適當的處理。
(2) 骨髓抑制 (頻度不明):表現為紅細胞減少、貧血、白細胞減少、中性粒細胞減少、血小板減少、出血傾向 (0.1-5%),應細心觀察末稍血象,發現異常,應延長給藥間隔、減量或停藥並進行適當的處理。
(3) 腎功能異常 (0.1%-5%):出現血尿素氮、血肌酐升高,肌酐清除率下降,β2球蛋白升高,以及血尿、蛋白尿、少尿、代償性酸中毒及尿酸升高等,發現異常,對於是否繼續給藥,應慎重檢查。
(4) 阿-斯綜合症 (Adams-Stokes Syndrome)發作:有報導因使用本品引起阿-斯綜合症而死亡的病例 (參照:注意事項12)。
(5) 聽覺障礙、聽力低下、耳鳴 (頻度不明):本品可引起耳神經系統毒性反應,表現為聽覺障礙、聽力低下、耳鳴。用藥期間應進行適當的聽力檢查並觀察患者的狀態,發現異常應停藥並做適當的處理;治療前用過其它鉑類製劑的、給藥前就有聽力低下、腎功能低下的患者應特別注意。
(6) 間質性肺炎 (頻度不明):對於伴有發熱、咳嗽、呼吸困難、胸部X線異常的間質性肺炎患者,應細心觀察,發現異常應終止給藥,並給予腎上腺皮質激素等藥物進行適當的處理。
(7) 抗利尿激素分泌異常綜合症 (SIADH)(頻度不明):表現為低鈉血症,低滲透壓血症,尿中鈉離子排泄增加,伴有高張尿、意識障礙等,發現這些症狀應終止給藥,並採取限制水分攝取等適當的方法處理。
2.其他不良反應:
種類\頻度 | 5%以上 | 0.1-5% |
神經系統 | 痙攣、頭痛、手足發冷等末梢神經功能障礙 | |
腎臟 | BUN升高(11.4%),血清肌酐清除率低下(25.3%),β2球蛋白升高 | 血尿、蛋白尿、少尿、代償性酸中毒、尿酸升高、NAC上升 |
消化系統 | 惡性、嘔吐(74.9%),食欲不振(59.5%),腹瀉 | 腸梗阻、腹痛、便秘、口腔炎症等 |
循環系統 | 心電圖異常(心動過速、ST波低下),心肌受損 | |
呼吸系統 | 呼吸困難 | |
泌尿系統 | 尿痛、排尿困難 | |
過敏症狀 | 變態反應(濕疹、發紅)、發疹等 | |
肝臟 | AST(GOT)升高(11.9%)、ALT(GPT)升高(12.3%) | 膽紅素升高、ALP上升、LDH升高、血清總蛋白減少、血清白蛋白降低 |
電解質 | 鈉、鉀、氯等電解質異常 | |
其他 | 如脫髮、全身性疲倦、發熱、靜脈炎、浮腫、潮紅、皰疹、白細胞增多(一過性) |
禁忌
以下患者禁用:
1.有明顯骨髓抑制及嚴重肝、腎功能不全者。
2.對其它鉑製劑及右旋糖酐過敏者。
3.孕婦、可能妊娠及有嚴重併發症的患者。
1.有明顯骨髓抑制及嚴重肝、腎功能不全者。
2.對其它鉑製劑及右旋糖酐過敏者。
3.孕婦、可能妊娠及有嚴重併發症的患者。
注意事項
1.本品應儘可能在具有腫瘤化療經驗的醫師指導下使用,慎重選擇患者,應具有應對緊急情況的處理條件。
2.聽力損害、骨髓、肝、腎功能不良、合併感染和水痘患者及老年人慎用。
3.本品有較強的骨髓抑制作用,並可能引起肝、腎功能異常。套用本品過程中應定期經常檢查血液、肝、腎功能並密切注意患者的全身情況,若發現異常應停藥並適當處置。對骨髓功能低下及腎功能不全及套用過順鉑者,應適當降低初次給藥劑量;本品長期給藥時,毒副反應有增加的趨勢,並有可能引起延遲性不良反應,應密切觀察。
4.注意出血傾向及感染性疾病的發生或加重。
5.本品主要由腎臟排泄,套用本品過程中須確保充分的尿量以減少尿中藥物對腎小管的毒性損傷。必要時適當輸液及使用甘露醇、速尿等利尿劑。由於有報導套用速尿等利尿劑時,會加重腎功能障礙,聽覺障礙,所以應進行輸液等以補充水分。另外,飲水困難或伴有噁心、嘔心、食欲不振、腹瀉等的患者應特別注意。
6.對噁心、嘔吐、食欲不振等消化道不良反應應注意觀察,並進行適當的處理。
7.合用其它抗惡性腫瘤藥物(氮芥類、代謝拮抗類、生物鹼、抗生素等)及放療可能使骨髓抑制加重。
8.育齡患者應考慮本品對性腺的影響。
9.本品只作靜脈滴注,應避免漏於血管外。
10.本品配製時,不可與其它抗腫瘤藥混合滴注,也不宜使用胺基酸輸液、pH5以下的酸性輸液(如電解質補液、5%葡萄糖輸液或葡萄糖氯化鈉輸液等)。
11.本品忌與含鋁器皿接觸。本品在存放及滴注時應避免直接日光照射。
12.本品在國外的臨床試驗中(共632例),突然死亡2例及因阿-斯綜合症(Adams-Stokes Syndrome,心臟傳導阻滯引起的腦缺氧綜合症)死亡1例。突然死亡的1例患者死於因高血壓而引起心功能不全;另1例患者死於既往心肌梗塞所引起的冠脈梗塞,或者由於腦部轉移引起的出血。阿-斯綜合症發作的1例,給藥前可見心電圖ST段降低,懷疑由於套用本品而引起的食欲不振、貧血是此次發作的誘因,但進行屍檢沒有異常發現,不能表明本品與此相關。
2.聽力損害、骨髓、肝、腎功能不良、合併感染和水痘患者及老年人慎用。
3.本品有較強的骨髓抑制作用,並可能引起肝、腎功能異常。套用本品過程中應定期經常檢查血液、肝、腎功能並密切注意患者的全身情況,若發現異常應停藥並適當處置。對骨髓功能低下及腎功能不全及套用過順鉑者,應適當降低初次給藥劑量;本品長期給藥時,毒副反應有增加的趨勢,並有可能引起延遲性不良反應,應密切觀察。
4.注意出血傾向及感染性疾病的發生或加重。
5.本品主要由腎臟排泄,套用本品過程中須確保充分的尿量以減少尿中藥物對腎小管的毒性損傷。必要時適當輸液及使用甘露醇、速尿等利尿劑。由於有報導套用速尿等利尿劑時,會加重腎功能障礙,聽覺障礙,所以應進行輸液等以補充水分。另外,飲水困難或伴有噁心、嘔心、食欲不振、腹瀉等的患者應特別注意。
6.對噁心、嘔吐、食欲不振等消化道不良反應應注意觀察,並進行適當的處理。
7.合用其它抗惡性腫瘤藥物(氮芥類、代謝拮抗類、生物鹼、抗生素等)及放療可能使骨髓抑制加重。
8.育齡患者應考慮本品對性腺的影響。
9.本品只作靜脈滴注,應避免漏於血管外。
10.本品配製時,不可與其它抗腫瘤藥混合滴注,也不宜使用胺基酸輸液、pH5以下的酸性輸液(如電解質補液、5%葡萄糖輸液或葡萄糖氯化鈉輸液等)。
11.本品忌與含鋁器皿接觸。本品在存放及滴注時應避免直接日光照射。
12.本品在國外的臨床試驗中(共632例),突然死亡2例及因阿-斯綜合症(Adams-Stokes Syndrome,心臟傳導阻滯引起的腦缺氧綜合症)死亡1例。突然死亡的1例患者死於因高血壓而引起心功能不全;另1例患者死於既往心肌梗塞所引起的冠脈梗塞,或者由於腦部轉移引起的出血。阿-斯綜合症發作的1例,給藥前可見心電圖ST段降低,懷疑由於套用本品而引起的食欲不振、貧血是此次發作的誘因,但進行屍檢沒有異常發現,不能表明本品與此相關。
孕婦及哺乳期婦女用藥
1.動物試驗中觀察到本品有致畸和引起胎兒死亡的作用,因此孕婦及可能妊娠的患者禁用本品。
2.有報導類似藥物順鉑可通過乳汁分泌,因此哺乳期婦女用藥時應終止授乳。
2.有報導類似藥物順鉑可通過乳汁分泌,因此哺乳期婦女用藥時應終止授乳。
兒童用藥
未進行該項實驗且無可靠參考文獻。
老年用藥
1.本品主要經腎臟排泄,由於一般老年人腎功能減退,排泄延遲,因此應注意觀察出現骨髓抑制的可能性。
2.建議老年患者初次用藥劑量為80mg/㎡
2.建議老年患者初次用藥劑量為80mg/㎡
藥物相互作用
1.本品與其他抗腫瘤藥(如烷化劑、抗代謝藥、抗腫瘤抗生素等)及放療並用時,骨髓抑制作用可能增強。
2.與氨基糖苷類抗生素及鹽酸萬古黴素合用時,對腎功能和聽覺器官的損害可能增加。
2.與氨基糖苷類抗生素及鹽酸萬古黴素合用時,對腎功能和聽覺器官的損害可能增加。
藥物過量
未進行該項實驗且無可靠參考文獻。
藥理毒理
藥理作用:
奈達鉑為順鉑類似物。本品進入細胞後,甘醇酸脂配基上的醇性氧與鉑之間的鍵斷裂,水與鉑結合,導致離子型物質(活性物質或水合物)的形成。然後,斷裂的甘醇酸脂配基變得不穩定並被釋放,產生多種離子型物質並與DNA結合。
本品以與順鉑相同的方式與DNA結合,並抑制DNA複製,從而產生抗腫瘤活性。另外,已經證實本品在與DNA反應時,所結合的鹼基位點與順鉑相同。
毒理研究:
重複給藥毒性:本品大鼠每周2次共一個月,每天(一次)連續1個月、每周一次共6個月及狗每周一次共6周靜脈注射給藥的毒理研究結果顯示,其毒性與順鉑類似,主要毒性靶器官為血液(紅細胞、血小板下降)、腎臟、胰腺。
遺傳毒性:本品Ames試驗陽性,體外(人淋巴細胞)及體內(小鼠骨髓細胞)染色體畸變試驗結果顯示本品可引起染色體畸變率明顯增高。
生殖毒性:家兔器官形成期靜脈注射本品劑量為500μg/kg時有致畸性,對胎仔的無影響劑量為250μg/kg。大鼠給藥劑量達540μg/kg時,可引起胎鼠骨化延遲,但對其外形、骨骼系統、發育等功能無明顯影響。
奈達鉑為順鉑類似物。本品進入細胞後,甘醇酸脂配基上的醇性氧與鉑之間的鍵斷裂,水與鉑結合,導致離子型物質(活性物質或水合物)的形成。然後,斷裂的甘醇酸脂配基變得不穩定並被釋放,產生多種離子型物質並與DNA結合。
本品以與順鉑相同的方式與DNA結合,並抑制DNA複製,從而產生抗腫瘤活性。另外,已經證實本品在與DNA反應時,所結合的鹼基位點與順鉑相同。
毒理研究:
重複給藥毒性:本品大鼠每周2次共一個月,每天(一次)連續1個月、每周一次共6個月及狗每周一次共6周靜脈注射給藥的毒理研究結果顯示,其毒性與順鉑類似,主要毒性靶器官為血液(紅細胞、血小板下降)、腎臟、胰腺。
遺傳毒性:本品Ames試驗陽性,體外(人淋巴細胞)及體內(小鼠骨髓細胞)染色體畸變試驗結果顯示本品可引起染色體畸變率明顯增高。
生殖毒性:家兔器官形成期靜脈注射本品劑量為500μg/kg時有致畸性,對胎仔的無影響劑量為250μg/kg。大鼠給藥劑量達540μg/kg時,可引起胎鼠骨化延遲,但對其外形、骨骼系統、發育等功能無明顯影響。
藥代動力學
腫瘤患者靜脈滴注奈達鉑80mg/㎡或100mg/㎡後,用原子吸收光譜分析法直接測定總鉑的方法研究本品的體內動態,結果顯示,奈達鉑單次靜脈滴注後,血漿中鉑濃度呈雙相性減少,t1/2α約為0.1-1小時,t1/2β約為2-13小時,AUC隨給藥量增大而增大。
本品在血漿內主要以游離形式存在,動物試驗可見本品在腎臟及膀胱分布較多,組織濃度高於血漿濃度。本品的排泄以尿排泄為主,24小時尿中鉑的回收率在40%-69%之間。
本品在血漿內主要以游離形式存在,動物試驗可見本品在腎臟及膀胱分布較多,組織濃度高於血漿濃度。本品的排泄以尿排泄為主,24小時尿中鉑的回收率在40%-69%之間。
貯藏
遮光,密閉,30℃以下保存。
包裝
中性硼矽玻璃管制注射劑瓶,10mg/瓶×5瓶/盒
有效期
24個月
執行標準
YBH08642008
批准文號
國藥準字H20030884
生產企業
南京先聲東元製藥有限公司
核准日期
2006年08月17日
修訂日期
2008年07月29日
2014年05月16日
