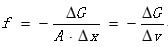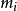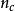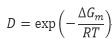生成形式
晶核的生成有三種形式:即初級均相成核、初級非均相成核及二次成核。在高過飽和度下,溶液自發地生成晶核的過程,稱為初級均相成核;溶液在外來物(如大氣中的微塵)的誘導下生成晶核的過程,稱為初級非均相成核;而在含有溶質晶體的溶液中的成核過程,稱為二次成核。二次成核也屬於非均相成核過程,它是在
晶體之間或晶體與其他固體(器壁、攪拌器等)碰撞時所產生的微小
晶粒的誘導下發生的。
相與相變化
所謂“相”是指物質存在的狀態,在同一相中,化學組成與物理性質是均勻的。以純水為例,它以水的液態、水蒸氣的氣態、及凍的固態三種狀態存在,分別稱為液相、氣相和固相。在多成分系統中,則可能一相內含多成分,或多個液相同時存在。以油水系統為例,在室溫中把半杯色拉油倒入半杯水中,可以看到油浮在水面上,形成不互溶的油相及水相,兩相成分不同。但如果把酒精倒入水中,因可互溶,只有一個液相存在,在這個液相中,化學組成是均勻的。另外,一個固體中也可能由多個固相所組成。比如一顆石頭中,常可發現含有很多色澤不太相同的小顆粒,這些小顆粒可能具有不同化學組成與結晶構造,而分屬不同的固相,或屬同相但被分散在其他相中。至於在什麼條件下,物質會以哪一相或哪些相共存的狀態存在,則是熱力學的重要探討目標之一。
同時,當溫度、壓力等環境條件改變時,物質可能從原來存在的相轉變成另一相,產生所謂的“相變化”而相變化產生的機制及速率,則是“成核理論”的研究目標。相變化的種類很多,常見的可分下列幾種:由氣相變為液相,稱為凝結;由液相變為氣相,若發生在液相內部或液相與容器界面稱沸騰,若發生在氣液界面則稱為蒸發;由液相變為固相,稱為固化或結晶;由固相變為液相,稱為熔化;其他尚有多種的相變化,尤其是多成分系統,可能的相變化種類更多。
至於相變化初始的成核現象,則分為下列兩種:均勻相成核──新相的胚核直接由原來母相中產生,例如多個水蒸氣分子自行聚集形成小水滴胚核;非均勻相成核──新的相以外加的核或容器表面為胚核而形成。一般而言,若有外來胚核存在時,非均勻相成核遠比均勻相成核容易發生。以水為例,在沒有任何外來胚核存在下,要讓直徑一公分的水珠冷卻至攝氏零下40度才能形成冰珠,這溫度遠低於一般水在攝氏零度可以結成凍的認知;然而在一般情況下,容器表面或水中微粒可充當胚核,讓水在約攝氏零下1度即可結冰。
熱力學
熱力學是研究各種形式能量間轉換的科學,而能量的轉換遵守了一些限制,也就是熱力學第一定律及第二定律:第一定律是能量守恆定律,各種形式的能量(如功、熱、動能等)不管它們之間如何轉換,其總和不變;第二定律則指出,沒有一個設備可以把吸收的熱完全轉換為功,也沒有任何一種程式可以單獨把熱由低溫傳到高溫。
由這兩個定律可進一步推導出各種熱力學性質(如熵、焓、自由能等)間的關係式,以及在描述相平衡時很重要的一個判斷標準:在某一溫度、壓力下,當一個獨立系統達到平衡狀態時,相對於所有可能的狀態,其總自由能(Gibbs free energy)恆維持在最低值,此一標準是判斷平衡狀態的通則。在定性上亦常以“趨向最低能量、最大亂度”來敘述一個系統變化的趨向。對於一個系統,其中的物質原本以某一相存在且處於平衡狀態,當溫度、壓力改變時,在新的條件下原本的平衡狀態不再是處於最低自由能的狀態,反而是以另一相的狀態存在時其自由能最低,則此系統就可能產生相變化。然而相變化是否必然產生呢?實則並不盡然,因為形成新相胚核過程中,隨著胚核的成長,自由能會先增加達到某一最大值後再下降。但熱力學第二定律告訴我們:在等溫等壓條件下,物質系統總是自發地從自由能較高的狀態向自由能較低的狀態轉變,只有伴隨著自由能降低的過程才能自發地進行成核,也即只有當新相的自由能低於舊相的自由能時,舊相才能自發地轉變為新相。即相變過程的驅動力是相變過程前後自由能的差。主要有以下三種形式:
一、相變過程的溫度條件熔體要結晶,該系統必須“過冷卻”,即系統實際溫度比理論相變溫度要低,才能使相變過程自發進行。它們間的差值T0 – T為這一相變過程的驅動力。
二、相變過程的壓力條件 要使凝聚相變自發進行,系統的飽和蒸氣壓應大於平衡蒸汽壓,這種過飽和蒸汽壓差P – P0 即為凝聚相變過程的驅動力。
三、相變過程的濃度條件對於溶液中析出固體的相變而言,為使相變過程自發進行,溶液要有過飽和濃度,它們之間的差值c – c0為這一相變過程的驅動力。相變驅動力的表達式為:
其中,A為晶體-流體的晶面面積;Dx為垂直於晶面的位移;DG為相變過程中系統吉布斯自由能的降低;f為晶面上單位面積的驅動力。
驅動力所作之功(f×A × Dx)=系統吉布斯自由能的降低(-DG)。結晶過程除需要體系處於過飽和或過冷狀態,以獲得結晶驅動力外,還要求體系中某些局部區域內,首先形成新相(晶相)的核。體系中將出現兩相界面,然後相界面逐步向舊相區內推移而使新相不斷長大。這種新相核的發生和長大稱為成核過程。簡單來說,若在溶液中不存在任何晶體,當溶液達到一定的過飽和狀態,溶液中的溶質會形成細小的晶體,我們稱這樣的過程為成核過程(初級成核),或在更廣泛的意義上講,所有形成可供晶體成長的晶體過程稱為成核過程。
均勻與非均勻
所謂成核就是指新相在舊相中開始形成時,並非在亞穩系統的全部體積內同時發生,而是在舊相中的某些位置產生小範圍的新相,在新相和舊相之間有比較清晰的界面將它們分開。這種在舊相中誕生小體積新相的現象就是成核。一次成核是指系統中不含有結晶物質時的成核。如果成核是自發產生的,而不是靠外來的質點或基底的誘發,這樣的成核就是均勻成核。相反,如果成核是靠外來的質點或基底的誘發而產生的,這樣的成核就叫做非均勻成核。有時,晶核可以在系統中已經存在的晶體附近產生,這種在有晶體存在的條件下的成核現象叫做二次成核。
均勻成核
均勻成核是指不考慮外來質點或表面存在的影響,在一個體系中各個地方成核的機率均相等。在平衡條件下,任一瞬間,由於熱漲落,體系某些局部區域總有偏離平衡的密度祈福,這時質點(原子或分子)可能一時聚集起來成為新相的原子團簇(晶核),另一瞬間這些團簇又拆散恢復原來的狀況。如體系處於過飽和或過冷的亞穩態,則這種起伏過程的總趨勢是促使舊相向新相過渡。形成的核可能穩定存在而成為核心。
當從母相中產生臨界晶核以後,它並不是穩定的晶核,而必須從母相中將原子或分子一個一個遷移到臨界晶核表面,並逐個加到晶核上,使其生長成穩定的晶核。在此,我們用成核速率來描述從臨界晶核到穩定晶核的生長。成核速率除了取決於單位體積母相中臨界晶核的數目外,還取決於母相中原子或分子加到臨界晶核上的速率,可以表示為:
式中:
為成核速率,指單位時間、單位體積中所生成的晶核數目,其單位為晶核個數/(s·cm3);v為單個原子或分子同臨界晶核碰撞的頻率;
為臨界晶核周邊的原子或分子數。碰撞頻率v表示為:
其中
為受成核位壘影響的成核速率因子;
為受原子擴散影響的成核速率因子;B為常數。上式表示了成核速率隨溫度的變化關係,當溫度降低,過冷度增大,由於ΔGc∝1/ΔT2,因而成核位壘下降,成核速率增大,直至達到最大值。如溫度繼續下降,液相粘度增加,原子或分子擴散速率降低,ΔGm增大,使D因子劇烈下降,致使Iv降低。成核速率Iv與溫度的關係應是曲線P和D的綜合結果,示於下圖。在溫度較低時,D因子抑制了Iv的增長;在溫度較高時,P因子抑制了Iv的增長;只有在合適的過冷度下,P與D因子的綜合結果使Iv獲得最大值。
均勻成核是在非常理想的情況下才能發生,實際成核過程都是非均勻成核,即體系里總是存在雜質、熱流不均、容器壁不平等不均勻的情況,這些不均勻性有效地降低了成核時的表面能位壘,核就先在這些部位形成。所以人工合成晶體總是人為地製造不均勻性使成核容易發生,如放入籽晶、成核劑等。
非均勻成核
熔體過冷或者溶液過飽和後不能立即成核的主要障礙是生成晶核時要出現液-固界面,為此需要提供界面能。如果成核依附於已有的界面上(如容器壁、雜質顆粒、結構缺陷、氣泡、成核劑等)形成,則高能量的液-固界面能就被低能量的晶核與成核基體之間的界面所取代。顯然,這種界面代換比界面的生成所需要的能量要少得多。因此,成核基體的存在可大大降低成核位壘,使成核能在較小的過冷度下進行。這種情況下,成核過程將不再均勻地分布在整個系統內,固常被稱為非均勻成核。
控制措施
1、維持穩定的過飽和度
2、限制晶體的生長速率
3、儘可能減低晶體的機械碰撞能量及幾率
4、對溶液進行加熱、過濾等預處理
5、使符合要求的晶粒得以及時排出
6、將含有過量細晶母液取出後細消後送回結晶器
7、調節pH值或加入具選擇性的添加劑以改變成核速率