德爾塔32突變基因是一種先天具有抵禦愛滋病病毒的能力的,自雙親遺傳的突變基因,它能夠阻礙愛滋病病毒對人體健康細胞的侵襲。據悉,歐美人從雙親身上遺傳這種“德爾塔32”突變基因的機率約為千分之一。德爾塔32突變基因源於14世紀的歐洲第一次大瘟疫時,得了黑死病卻存活下來的人,並在此後的大瘟疫來襲時,保護了這些人的後代。
基本介紹
- 中文名:德爾塔32突變基因
- 能力:先天具有抵禦愛滋病病毒
- 性質:遺傳的突變基因
- 功能:阻礙愛滋病病毒侵襲
簡介,CCR5突變原因猜想,詳細介紹,相關研究,
簡介
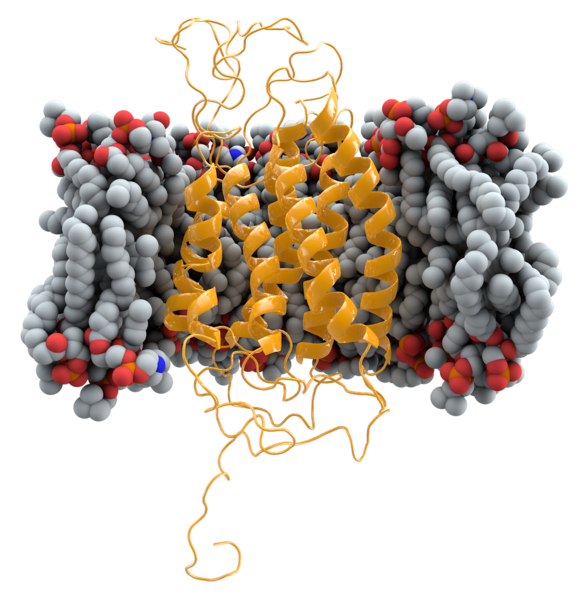
大多數的HIV都是通過與CCR5結合來感染宿主細胞。少數的CCR5基因攜帶被稱為CCR5-Δ32的突變體,這種由突變基因編碼的CCR5突變體可以不被HIV毒株侵染。CCR5△32是指CCR5基因的32個鹼基缺失的突變,即在CCR5等位基因編碼區域第185位胺基酸密碼子以後發生了32個鹼基缺失,導致讀碼框架錯位,缺失了與G蛋白信號通路相關的胞外第三環結構,從而使CCR5蛋白無法正常穿膜表達於細胞膜上,進而使HIV-1 gp120不能與CCR5△32有效結合,使HIV-1病毒不能進入宿主細胞。人群調查和實驗研究結果表明,CCR5△32缺失的個體擁有正常的免疫功能和炎症反應,並且對HIV-1的感染表現出顯著的抵禦能力,因此,作用於CCR5的抑制劑將有效阻斷HIV-1感染。
但是帶有CCR5突變基因的人群極少,例如,只有10%的歐洲人群中帶有CCR5變異基因,加上造血幹細胞移植還要進行配型,因而,一般人希望依靠該基因突變來徹底治癒癌症還尚待時日。
CCR5突變原因猜想
鼠疫來源
大約10%的歐洲人攜帶CCR5的突變體,由於該CCR5突變被認為是在700年前出現的,遠在愛滋病出現之前,因此生物學家構想CCR5突變亦抵抗另一種鼠疫桿菌病原體,因為鼠疫桿菌曾在14世紀造成了高達40%的歐洲人死亡。該種突變在人群中遺傳下來,因為在後來的鼠疫爆發期間,攜帶有該突變的歐洲人得以幸免於難。
天花來源
另有研究者通過計算認為,鼠疫桿菌並非CCR5突變的緣由。儘管腺鼠疫在很短時間內造成的歐洲死亡人數比任何其它疾病都多,但數學模型表明,鼠疫爆發的次數終究太少,使之不可能引起常規的CCR5突變。而感染歐洲人達2千多年的天花,所造成的歐洲總死亡人數,則遠比鼠疫要多得多。鼠疫主要導致兒童死亡,因而不能使具有抗性的基因遺傳給後代,而天花卻具有易於突變的劣性。迦爾瓦尼和斯拉特金還認為,天花病毒也具有易於感染免疫細胞的生物學特性,因為在這方面,它與愛滋病毒的行為方式極為相似。
詳細介紹
後天免疫缺乏症候群患者所遭遇嚴重的病理呈現,主要源自於人類免疫缺乏病毒的感染。此病毒屬於一種反轉錄病毒,主要針對人類免疫系統重要的組成進行感染並改變其運作模式,包括輔助型T細胞、巨噬細胞、和樹突細胞(dendritic cell)等,其中又以直接破壞細胞膜上具有CD4辨識蛋白特徵的T細胞(簡寫作CD4T細胞)的結果最為嚴重,因為CD4 T細胞是人體免疫系統辨識外來物質過程中,不可或缺的元素之一,一旦CD4T細胞受到感染而不表現CD4辨識蛋白,或甚至造成此種細胞死亡,導致每微升血液中CD4T細胞數量低於200時,細胞免疫(cellular immunity)就幾乎完全失去功能,進而導致平時不易感染健康人類的微生物得以大肆入侵,由於受HIV感染個體無法有效分辨敵我,最後導致嚴重的各種感染症,總稱後天免疫缺乏症候群。
根據流行病學統計,在未使用抗反轉錄病毒藥物治療的情況下,自感染病毒至出現症狀的潛伏過程的中位數約為9至10年,自正式出現後天免疫缺乏症候群起算,存活時間的中位數亦僅有9.2個月然而,臨床觀察到的疾病進程速度受到許多因素影響,在個體之間有很大的變異,短則兩周、長可達20年。這些因素甚至也包含了愛滋病毒所攻擊的免疫系統總體狀況,因此從感染開始到發病,甚至其變化程度,都一直受到感染者免疫力和病毒活動之間的互動所影響。舉例而言,一般年長者免疫力較差,因此相對於年輕患者而言,病程發展迅速的風險較高;醫療的品質和同時存在的感染症(如結核)也會使得HIV感染者處於較為不利的狀態。
此外,遺傳也左右了感染過程和感染後的狀況,有些人因帶有編號為CCR5-Δ32的突變基因,對特定的HIV病毒株具有抵抗力。更有研究指出,羅馬帝國子民後代更易感染HIV:在西班牙、義大利和希臘這些長期處於羅馬帝國核心的地方,他們的CCR5-delta32基因出現率為0%-6%。而在羅馬帝國邊疆地區、比如英格蘭和德國,這種基因出現率則是8%-11%。那些從來沒有被羅馬占領過的國家,CCR5-delta32基因出現率更高。該基因變異的頻繁度,正與古羅馬版圖的變遷吻合 。此外,由於HIV病毒本身在演化過程中亦會產生變異,不同品系也可引起不同程度的臨床表現。
相關研究
在近期一項相關研究中,美國研究人員 說,他們藉助一種改造免疫 T 細胞的基因療法,成功讓一名暫停服用抗逆轉錄病毒藥物者體內的愛滋病病毒消失。他們表示,儘管這與該感染者先天具有一種有利的突變基因有關,但有關結果表明基因療法將來有望促進“功能性治癒”某些愛滋病病毒感染者。
這項 I 期研究由來自賓夕法尼亞大學醫學院、阿爾伯特愛因斯坦醫學院的研究人員和加州 Sangamo BioSciences 生物醫學公司的科學家們合作完成。Sangamo BioSciences 開發了臨床實驗中所採用的鋅指核酸酶(ZFN)技術和 T 細胞療法。
人體免疫 T 細胞的細胞膜表面有一種名為 CCR5 的蛋白質受體,這種受體就像愛滋病病毒入侵免疫細胞的通道,該病毒通常要與這種受體結合,才能進入免疫細胞。科研人員早先發現,少數歐洲人體內的 CCR5 基因存在變異,導致其編碼合成的 CCR5 蛋白質受體表達異常,這相當於將愛滋病病毒進入 T 細胞的大門關閉,使這些人對愛滋病病毒天生具有抵禦能力。
研究人員在《新英格蘭醫學雜誌》(NEJM)上報告說,他們從 12 名愛滋病病毒感染者體內提取未被感染的 T 細胞,並對該細胞的 CCR5 基因進行改造,讓愛滋病病毒無法通過其合成的 CCR5 蛋白質受體進入這些細胞內。
研究人員把改造後的 T 細胞注回感染者體內,每人一次性注入 100 億個 T 細胞。這 12 名感染者被分為兩組,每組 6 人,其中一組 4 周后開始停止服用抗逆轉錄病毒藥物 12 周。在停藥的 6 名感染者中,有 4 人體內的愛滋病病毒數量變少,還有 1 人病毒檢測結果呈陰性。研究人員後來發現,這名感染者體內本來就有 CCR5 突變基因。
這項 I 期研究由來自賓夕法尼亞大學醫學院、阿爾伯特愛因斯坦醫學院的研究人員和加州 Sangamo BioSciences 生物醫學公司的科學家們合作完成。Sangamo BioSciences 開發了臨床實驗中所採用的鋅指核酸酶(ZFN)技術和 T 細胞療法。
人體免疫 T 細胞的細胞膜表面有一種名為 CCR5 的蛋白質受體,這種受體就像愛滋病病毒入侵免疫細胞的通道,該病毒通常要與這種受體結合,才能進入免疫細胞。科研人員早先發現,少數歐洲人體內的 CCR5 基因存在變異,導致其編碼合成的 CCR5 蛋白質受體表達異常,這相當於將愛滋病病毒進入 T 細胞的大門關閉,使這些人對愛滋病病毒天生具有抵禦能力。
研究人員在《新英格蘭醫學雜誌》(NEJM)上報告說,他們從 12 名愛滋病病毒感染者體內提取未被感染的 T 細胞,並對該細胞的 CCR5 基因進行改造,讓愛滋病病毒無法通過其合成的 CCR5 蛋白質受體進入這些細胞內。
研究人員把改造後的 T 細胞注回感染者體內,每人一次性注入 100 億個 T 細胞。這 12 名感染者被分為兩組,每組 6 人,其中一組 4 周后開始停止服用抗逆轉錄病毒藥物 12 周。在停藥的 6 名感染者中,有 4 人體內的愛滋病病毒數量變少,還有 1 人病毒檢測結果呈陰性。研究人員後來發現,這名感染者體內本來就有 CCR5 突變基因。