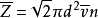碰撞是氣體分子運動的基本特徵之一,分子間通過碰撞來實現動量或動能的交換,使熱力學系統由非平衡態向平衡態過渡,並保持平衡態的巨觀性質不變。單位時間內一個氣體分子與其他氣體分子發生碰撞的平均次數,稱為平均碰撞頻率。
基本介紹
- 中文名:平均碰撞頻率
- 外文名:Average Collision Frequency
概念,碰撞過程,計算方式,
概念
分子間的碰撞實質上是在分子力作用下分子相互間的散射過程。對單個分子來說,單位時間內與多少個分子相碰、相鄰兩次碰撞之間走過多少直線路程,方向如何,完全是隨機的。但在平衡態下,對大量分子而言,每個分子在單位時間內與其他分子碰撞次數的統計平均值,卻是一定的,稱為平均碰撞頻率,用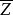 表示。
表示。
碰撞過程
分子間的碰撞實質上是在分子力作用下分子相互間的散射過程。當兩分子接近到一定距離時,最初起作用的是吸引力,引起勢能減小,動能增大;當兩分子非常接近時,斥力起主要作用,這時勢能增加,動能減少。當動能全部轉化為勢能,分子的速度成為零,分子不能再相互趨近時,分子在強大的斥力作用下被排斥開來,這便是分子間的彈性碰撞過程。兩個分子的質心所能達到的最小距離的平均值用d表示,稱為分子的有效直徑。實驗表明分子有效直徑的數量級為10-10m。
計算方式
為了使計算簡單,假定每個分子都是直徑為 的剛性小球。此處
的剛性小球。此處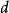 就稱為分子的有效直徑(effective diameter)。分子間的相互作用過程看做是剛性小球的彈性碰撞,且碰撞在同一種分子中進行。跟蹤一個分子,假定其他分子靜止不動,該分子以平均相對速率
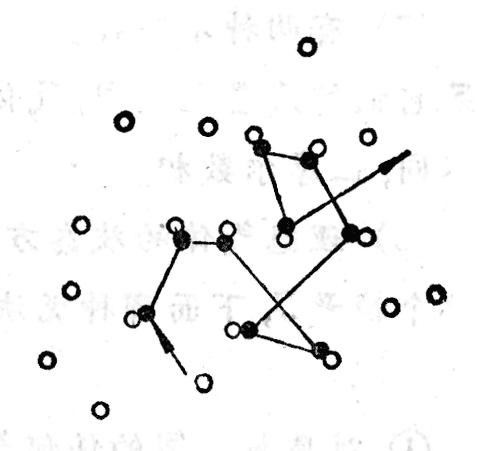
就稱為分子的有效直徑(effective diameter)。分子間的相互作用過程看做是剛性小球的彈性碰撞,且碰撞在同一種分子中進行。跟蹤一個分子,假定其他分子靜止不動,該分子以平均相對速率 運動。跟蹤的是A分子,如圖6-9所示,計算它在出時間內與多少分子相碰。
運動。跟蹤的是A分子,如圖6-9所示,計算它在出時間內與多少分子相碰。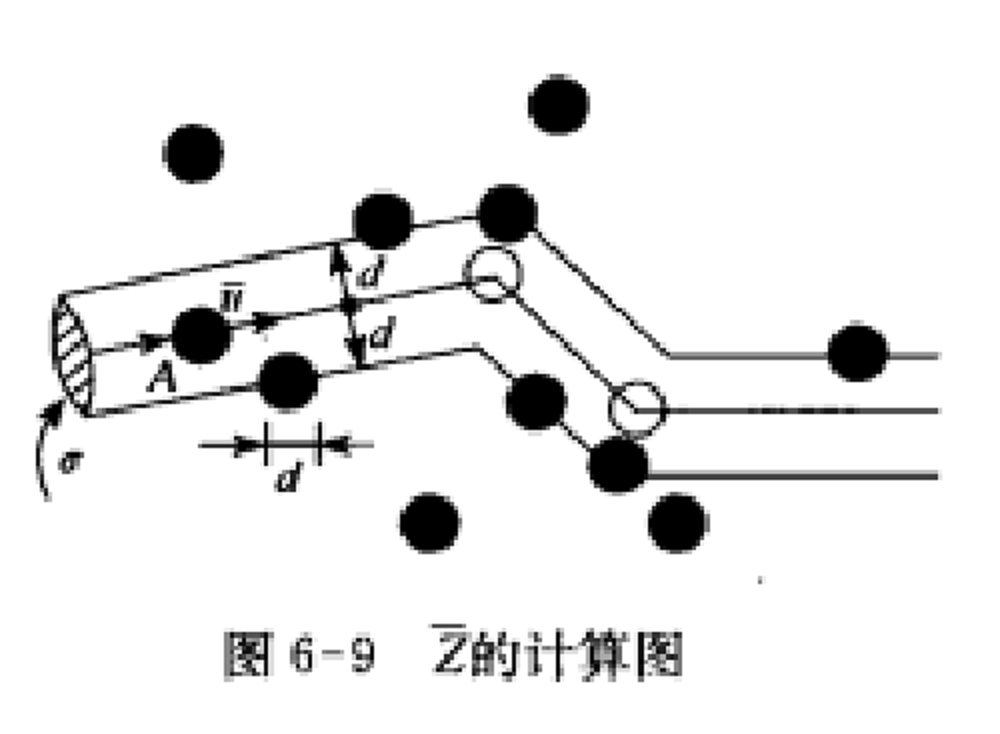 平均碰撞頻率計算圖
平均碰撞頻率計算圖

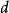

 平均碰撞頻率計算圖
平均碰撞頻率計算圖在分子A的運動過程中,顯然只有其中心與A的中心之間相距小於或等於分子有效直徑的那些分子才能與A相碰.因此,為了確定在一段時間內有多少個分子與A碰撞,可構想以A為中心的運動軌跡為軸線,以分子有效直徑為半徑作一個曲折的圓柱體。這樣,凡是中心在此圓柱體內的分子都會與A相碰,而圓柱體外的分子將不能與A相碰。圓柱體的截面積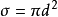 稱做分子的碰撞截面(collision cross-section)。
稱做分子的碰撞截面(collision cross-section)。
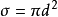
在時間 內,A分子所走過的路程為
內,A分子所走過的路程為 ,相應的圓柱體的體積為
,相應的圓柱體的體積為 。若以
。若以 表示分子數密度,則此圓柱體內的分子數為
表示分子數密度,則此圓柱體內的分子數為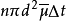 。根據前面所述,這就是分子A在
。根據前面所述,這就是分子A在 時間內與其他分子的碰撞次數。因此,分子A的平均碰撞頻率為:
時間內與其他分子的碰撞次數。因此,分子A的平均碰撞頻率為:




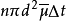


式中,相對平均速率 套用起來不太方便,需要把它和平均速率聯繫起來。考慮兩分子A和B的碰撞,其平均速率(對地)均為
套用起來不太方便,需要把它和平均速率聯繫起來。考慮兩分子A和B的碰撞,其平均速率(對地)均為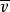 ,但平均速度方向不同。由於分子運動的無規則性,兩分子速度方向之間的夾角從0°~180°各個方向的機率都相等,因此,平均來說,兩分子碰撞時速度間的夾角為90°,如圖6-10所示。由速度合成定理,相對平均速度
,但平均速度方向不同。由於分子運動的無規則性,兩分子速度方向之間的夾角從0°~180°各個方向的機率都相等,因此,平均來說,兩分子碰撞時速度間的夾角為90°,如圖6-10所示。由速度合成定理,相對平均速度 應是
應是 與的
與的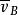 的矢量差。由於
的矢量差。由於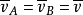 ,將此結果代入上式,可得
,將此結果代入上式,可得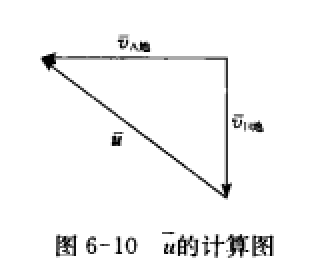 平均速度計算圖
平均速度計算圖

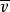


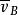
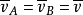
 平均速度計算圖
平均速度計算圖