尺寸因素化合物,有一些金屬間化合物,其晶體結構主要取決於組元原子的半徑比。這樣的化合物稱為尺寸因素化合物。它包括兩類。一類是由金屬與金屬元素形成的密排相,另一類是金屬與非金屬元素形成的間隙相。
基本介紹
- 中文名:尺寸因素化合物
- 晶體結構:取決於組元原子的半徑比
- 前提:金屬間化合物
- 分類:由金屬與金屬元素形成的密排相
密排相,間隙相,參考資料,
密排相
密排相的原子排列遵從以下三原則:
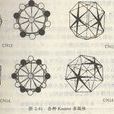
(1)空間填充原則:原子應儘可能緻密地填滿空間,或者說,應具有儘可能高的配位數。對於由同種原子(同樣尺寸的剛性球)組成的合金來說最高配位數就是12。對於不同種原子(不同尺寸的剛性球)組成的合金來說,最高配位數可為14,15和16(見圖2-81)。例如,在周期表中已知結構的91個元素中,有52個是配位數為12的FCC或CPH結構。如果允許10%的距離偏差,則密排結構的元素達到58個。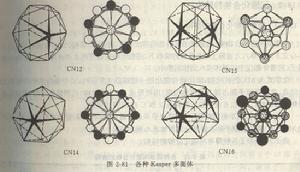 圖2-81 各種Kasper多面體
圖2-81 各種Kasper多面體
 圖2-81 各種Kasper多面體
圖2-81 各種Kasper多面體(2)對稱原則:晶體中原子的排列應形成高對稱的結構。例如,在91個元素中只有對稱性較高的FCC、CPH和BCC結構,而沒有對稱性較低的、配位數為9、10或11的結構。
(3)連線原則:如果將晶體中相距最近的每對原子逐一連線,那么由於晶體結構的不同,被連線的原子有可能形成孤立的原子對(零維)、原子鏈(一維)、平面原子網路(二維)、空間原子柵格(三維),他們分別稱為島狀、鏈狀、網狀和柵狀連線,用字母I,C,N和L表示。連線原則指出,具有密排結構的晶體中往往形成三維柵狀連線。
現在的問題是,原子應按什麼方式排列才能滿足以上三條原則、形成密排晶體結構呢?分析各種晶體後發現,有兩種密排方式,即幾何密排和拓撲密排,它們分別形成幾何密排相(GCP相)和拓撲密排相(TCP相)。
幾何密排相是由密排原子面(FCC晶體中的{111}面或CPH晶體中的(0001)面)按一定次序堆垛而成的結構。堆垛次序可以有多種,如ABCABC…(c型),ABAB…(h型),ABCACB…(cch型)等等。幾何密排相中近鄰原子彼此相切,配位數為12,結構中有兩種間隙:四面體間隙和八面體間隙。
拓撲密排相是由密排四面體按一定次序堆垛而成的結構。每個四面體的4個頂點均被同一種原子占據,且彼此相切。不同種類原子所占的四面體,其大小和形狀均不相同,可以是規則的,也可以是不規則的。
拓撲密排相的特點歸納如下:
(1)密排:由於拓撲密排相的各組元原子大小不同,且符合一定的原子半徑比,故TCP相中的原子比FCC,CPH純金屬或其它GCP相更緻密地填充整個空間。
(2)高配位數:TCP相具有高的配位數(CN12,CN14,CN15和CN16),而且不同組元原子或在不同位置的原子可以有不同的配位數,這是不同於GCP相的,後者只有一個配位數。
(3)層狀結構:TCP相可以看成是由兩類原子的密排層依次相間堆垛而成。
(4)四面體堆垛:TCP相往往也可以看成是由規則或不規則四面體無間隙地填滿整個空間而形成的。
(5)Kasper相和Kasper多面體:上述由四面體堆垛而成的TCP相也稱為Kasper相,因為Kasper等人發現,這樣的TCP相也可以看成是由各種配位多面體(稱為Kasper配位多面體)堆垛而成。
所謂Kasper配位多面體是以給定原子為中心,以其最近鄰原子(不論哪類原子,也不要求這些原子到給定原子的距離都一樣)為頂點的多面體。顯然,給定原子的配位多面體的頂點數V就等於該原子的配位數CN。由於不同種類的原子可能有不同的配位數,因而給定的TCP相可能是由不同形狀和尺寸的Kasper多面體堆垛而成。Kasper多面體的表面數F、棱(邊)數E和頂點數V應有以下關係(歐拉定理):V-E+F=2。
根據拓撲學和晶體學知識可以證明,能無間隙地填滿整個空間的Kasper多面體必須具有以下特點:(1)多面體的各外表面都是三角形;(2)多面體是凸的;(3)每個頂點有5或6條棱相遇。為了滿足這些條件,Kasper多面體的頂點數(或配位數)只能是12,14,15和16。相應的多面體分別記為CN12,CN14,CN15和CN16。圖2-81畫出了這些多面體及頂點原子的分布圖。圖中用平行線連線的原子是位於平行於紙面的同一層上,而對於用V形線連線的一對原子,則粗的一端(開口端)的原子在尖的一端(閉合端)的原子的上層。
值得指出的是,Kasper多面體都可以劃分成頂點在多面體中心的四面體,故Kasper多面體無間隙地填滿空間和四面體無間隙地填滿空間是一回事。
間隙相
由原子半徑較大的過渡族金屬元素和原子半徑較小的準金屬元素H,B,C,N,Si等形成的金屬間化合物稱為間隙化合物或間隙相,因為在這種化合物中準金屬原子是位於金屬結構的間隙中。間隙相也稱Hagg相,因為Gunnar Hagg對這類化合物進行過系統的研究。
間隙相通常可用一個化學式表示,並具有特定的結構。此結構往往不同於純組元的結構,而是取決於準金屬元素X與過渡族金屬元素M的原子半徑比。Hagg指出,當原子半徑比小於0.59時,形成結構簡單的間隙相,並具有簡單的化學式,當原子半徑比大於0.59時,形成結構複雜的間隙相。Hagg還指出,當原子半徑比等於0.23時,準金屬原子占據過渡族金屬結構的四面體間隙;而當原子半徑比在0.41和0.59之間時則占據八面體間隙。在有些文獻上,把上述區分間隙化合物的規則稱為Hagg規則。
間隙化合物,特別是簡單的間隙化合物,具有以下一些特性:
(1)雖然原子半徑比是決定結構的主要因素,因而這種化合物也可歸為尺寸因素化合物,但價電子濃度因素對結構也有很大影響。這就是為什麼當金屬組元M是BCC時,間隙化合物MX往往是FCC或CPH,而不是X原子填在BCC點陣間隙中。業已發現,簡單間隙相的結構和價電子濃度有很好的對應關係。
(2)雖然間隙化合物可以用一個化學式表示,但大多數間隙化合物的成分可以在一定的範圍內變化。顯然,當某類間隙被準金屬原子填滿是成分就達到了上限。此外,許多間隙相還具有很寬的相互固溶範圍,甚至形成連續固溶體。例如,由Ti,Zr,V,Nb,Ta的碳化物彼此形成的二元系幾乎都具有完全固溶範圍。Ti,Zr,V,Nb的氮化物也是這種情況。
(3)雖然間隙化合物中準金屬元素的含量很高,但它仍具有明顯的金屬性質。例如有金屬光澤,良好的導電性、正的電阻溫度係數等。
(4)間隙化合物一般具有很高的熔點、極高的硬度和脆性。這種化合物彌散在鋼中就使鋼硬化,耐磨。高速切削工具鋼的耐磨性就來源於多種間隙化合物的共同作用。
(5)間隙化合物中的結合鍵是混合型的:金屬原子之間是通過d電子形成金屬鍵,而金屬與準金屬原子之間則通過金屬的d電子和準金屬的p電子形成很強的定向(八面體)共價鍵。金屬鍵決定了間隙化合物的明顯金屬性質,共價鍵則決定了它的高熔點、高硬度和脆性。
(6)某些間隙化合物具有超導性。非超導材料Pd,Pd-Ag和Pd-Cu在加入間隙元素H後也變成超導材料。
(7)過渡族金屬的硼化物和磷化物可通過快冷而成為非晶態材料,其力學和電學性能類似於鋼。
參考資料
《材料科學基礎》潘金生、田民波編著,清華大學出版社1996年版