基本介紹
- 中文名:安培滴定法
- 類型:物理名詞
分類
 安培滴定法
安培滴定法極譜滴定法
方法
 安培滴定法
安培滴定法套用
永停終點法或雙指示電極安培法
方法
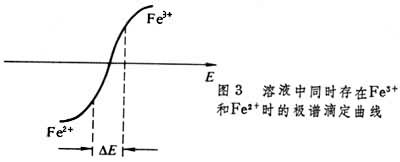 安培滴定法
安培滴定法 安培滴定法
安培滴定法套用
 安培滴定法
安培滴定法
 安培滴定法
安培滴定法 安培滴定法
安培滴定法 安培滴定法
安培滴定法 安培滴定法
安培滴定法 安培滴定法
安培滴定法安培滴定法亦稱電流滴定法,是在電解池中根據溶液的電流變動來指示滴定終點的電極滴定化學分析方法,其中又可以分為一個極化電極和兩個極化電極。把滴汞電極當作極化...
電流滴定法(amperometric titration)又稱安培滴定法,電化學分析法的一種。...... 電流滴定法(amperometric titration)又稱安培滴定法,電化學分析法的一種。...
雙安培滴定法(doubleamperometrictitration),又稱永停滴定法(dead-stoptitration)或雙電流滴定法,是根據滴定過程中電流的變化確定滴定終點的方法,屬於電流滴定法。...
電流滴定又稱安培滴定。利用擴散電流的變化以確定終點的滴定法。所用檢流計和電極均與極譜法相同。其指示電極為滴汞電極或鉑絲微電極。...
雙電流滴定法,又稱永停滴定法(dead-stoptitration)或雙安培滴定法(doubleamperometrictitration),是根據滴定過程中雙鉑電極的電流隨著滴定液的加人而發生的變化來確定...
在電位法中,利用測定電池的電動勢,即可由能斯特公式推知在指示電極上發生反應的離子濃度。屬於電流型的有極譜法和伏安法或安培滴定法中所用的滴汞電極和各種固體...
永停滴定法是根據滴定過程中雙鉑電極電流的變化來確定化學計量點的電流滴定法,又稱雙電流或雙安培滴定法。永停滴定法就是依據在外加小電壓下,溶液中有可逆電對...
“化學模式識別基本原理”、“簡議公眾健康風險評價方法在環境質量評價模式中的套用”、“模糊集環境綜合評價數學模式研究”、“安培滴定法測定鎿研究”、“區域環境...
在電位法中,利用測定電池的電動勢,即可由能斯特公式推知在指示電極上發生反應的離子濃度。屬於電流型的有極譜法和伏安法或安培滴定法中所用的滴汞電極和各種固體...
