妥抒(來氟米特片),適應症為成人類風濕性關節炎。
基本介紹
- 藥品名稱:妥抒
- 藥品類型:處方藥、醫保工傷用藥
- 用途分類:其他免疫抑制劑
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,批准文號,生產企業,核准日期,修訂日期,
成份
本品主要成分為來氟米特。
化學名稱:N-(4-三氟甲基苯基)-5-甲基異噁唑-4-羧醯胺。
化學結構式:
分子式:C12H9F3N202
分子量:270.2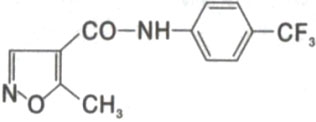
化學名稱:N-(4-三氟甲基苯基)-5-甲基異噁唑-4-羧醯胺。
化學結構式:
分子式:C12H9F3N202
分子量:270.2

性狀
本品為薄膜衣片,除去包衣後顯白色。
適應症
成人類風濕性關節炎。
規格
10 mg
用法用量
睡前口服,每日一次,每次20毫克(2片)。
使用本藥治療期間,可繼續使用非甾體類抗炎鎮痛藥或低劑量皮質類固醇藥物。
使用本藥治療期間,可繼續使用非甾體類抗炎鎮痛藥或低劑量皮質類固醇藥物。
不良反應
主要表現為:白細胞下降、瘙癢、食慾下降、乏力、頭暈、腹瀉、輕度肝損傷、皮疹和噁心等。
國外同類藥物進行Ⅲ期臨床試驗時,1-3%的患者出現如下不良反應:
全身性:膿腫,囊腫,發燒,頸痛,不適和骨盆痛;
心血管:心絞痛,偏頭痛,心悸,心動過速,靜脈曲張,脈管炎和血管舒張;
消化系統:膽結石,結腸炎,便秘,食管炎,氣脹,黑便,咽炎,唾液腺肥大,牙齦炎,口腔炎和牙齒排列不整齊;
內分泌:糖尿病和甲狀腺功能亢進;
血液和淋巴系統:貧血(缺鐵性貧血)和紫癜;
代謝和營養:肌酸磷酸激酶活性升高,高血糖和高血脂;
肌肉骨骼系統:關節炎,骨壞死,骨痛,粘液囊炎和肌肉痙攣;
呼吸系統:肺部不適,氣喘,呼吸困難和鼻出血;
神經系統:焦慮,抑鬱,口乾,失眠,神經痛,神經炎,睡眠紊亂,出汗和眩暈;
皮膚和附屬物:痤瘡,接觸性皮炎,真菌性皮炎,毛髮變色,單純性皰疹,帶狀皰疹,斑丘疹,指甲異常,皮膚變色,皮膚異感,皮膚小結,皮下結和皮膚潰瘍;
泌尿生殖系統:蛋白尿,血尿,膀胱炎,排尿困難,前列腺炎和尿頻,月經不調,陰道念珠菌病;
感官:視力模糊,白內障,眼部不適,結膜炎,味覺倒錯。
國外同類藥物進行Ⅲ期臨床試驗時,1-3%的患者出現如下不良反應:
全身性:膿腫,囊腫,發燒,頸痛,不適和骨盆痛;
心血管:心絞痛,偏頭痛,心悸,心動過速,靜脈曲張,脈管炎和血管舒張;
消化系統:膽結石,結腸炎,便秘,食管炎,氣脹,黑便,咽炎,唾液腺肥大,牙齦炎,口腔炎和牙齒排列不整齊;
內分泌:糖尿病和甲狀腺功能亢進;
血液和淋巴系統:貧血(缺鐵性貧血)和紫癜;
代謝和營養:肌酸磷酸激酶活性升高,高血糖和高血脂;
肌肉骨骼系統:關節炎,骨壞死,骨痛,粘液囊炎和肌肉痙攣;
呼吸系統:肺部不適,氣喘,呼吸困難和鼻出血;
神經系統:焦慮,抑鬱,口乾,失眠,神經痛,神經炎,睡眠紊亂,出汗和眩暈;
皮膚和附屬物:痤瘡,接觸性皮炎,真菌性皮炎,毛髮變色,單純性皰疹,帶狀皰疹,斑丘疹,指甲異常,皮膚變色,皮膚異感,皮膚小結,皮下結和皮膚潰瘍;
泌尿生殖系統:蛋白尿,血尿,膀胱炎,排尿困難,前列腺炎和尿頻,月經不調,陰道念珠菌病;
感官:視力模糊,白內障,眼部不適,結膜炎,味覺倒錯。
禁忌
以下患者禁用:
1.對來氟米特及其代謝產物過敏者;
2.孕婦及尚未採取可靠避孕措施的育齡婦女及哺乳期婦女。
1.對來氟米特及其代謝產物過敏者;
2.孕婦及尚未採取可靠避孕措施的育齡婦女及哺乳期婦女。
注意事項
1.嚴重免疫缺陷病人,骨髓發育不良者,乙型或C型肝炎患者,嚴重或無法控制感染患者和活疫苗免疫時不宜使用本品。
2.準備生育的男性應考慮停止治療,同時服用消膽胺或活性炭。
3.如來氟米特使用過程中,出現罕見不良反應,如骨髓抑制,斯-約二氏綜合症,毒性表皮壞死,停止服用來氟米特,同時服用消膽胺或活性炭,降低血漿中M1水平。
4.來氟米特使用過程中,可出現一過性丙氨酸氨基轉移酶(ALT)升高,故服用初期,應每月檢測一次ALT。如ALT升高在正常值2倍以內([80U/L),繼續觀察:如ALT升高在正常值2倍~3倍(80~120U/L),減半量服用,繼續觀察。若ALT繼續升高或仍然維持在80~120U/L,應中斷治療;如ALT大於正常值3倍以上(]120U/L),應停藥,且進行消膽胺或活性炭治療。停藥後,ALT恢復正常,可繼續用藥,同時加強護肝治療及隨訪,多數病人不會出現ALT再次升高。
5.服用期間出現白細胞下降,如白細胞>3×109/L,繼續服用觀察;如白細胞在2×109/L~3×109/L之間,減半觀察,繼續用藥期間,多數病人可恢復正常,若複查白細胞仍低於3×109/L,則中斷治療;如白細胞<2×109/L,中斷治療。
6.如患者有血液異常病史或腎功能和肝功能不全患者,使用本品時應慎重,經常進行血液和臨床檢測。
7.如果劑量過大或出現毒性時。可給予消膽胺或活性炭加以消除。具體方法:口服消膽胺3次/日,每次8克,連續服用11天,1天M1血漿濃度降低約40%,2天降低約49%~65%,11天降低約0.02ug/mL。或者通過胃管或口服給予活性炭(混懸液),每6小時50克,1天M1血漿濃度降低約37%,2天降低約48%。
2.準備生育的男性應考慮停止治療,同時服用消膽胺或活性炭。
3.如來氟米特使用過程中,出現罕見不良反應,如骨髓抑制,斯-約二氏綜合症,毒性表皮壞死,停止服用來氟米特,同時服用消膽胺或活性炭,降低血漿中M1水平。
4.來氟米特使用過程中,可出現一過性丙氨酸氨基轉移酶(ALT)升高,故服用初期,應每月檢測一次ALT。如ALT升高在正常值2倍以內([80U/L),繼續觀察:如ALT升高在正常值2倍~3倍(80~120U/L),減半量服用,繼續觀察。若ALT繼續升高或仍然維持在80~120U/L,應中斷治療;如ALT大於正常值3倍以上(]120U/L),應停藥,且進行消膽胺或活性炭治療。停藥後,ALT恢復正常,可繼續用藥,同時加強護肝治療及隨訪,多數病人不會出現ALT再次升高。
5.服用期間出現白細胞下降,如白細胞>3×109/L,繼續服用觀察;如白細胞在2×109/L~3×109/L之間,減半觀察,繼續用藥期間,多數病人可恢復正常,若複查白細胞仍低於3×109/L,則中斷治療;如白細胞<2×109/L,中斷治療。
6.如患者有血液異常病史或腎功能和肝功能不全患者,使用本品時應慎重,經常進行血液和臨床檢測。
7.如果劑量過大或出現毒性時。可給予消膽胺或活性炭加以消除。具體方法:口服消膽胺3次/日,每次8克,連續服用11天,1天M1血漿濃度降低約40%,2天降低約49%~65%,11天降低約0.02ug/mL。或者通過胃管或口服給予活性炭(混懸液),每6小時50克,1天M1血漿濃度降低約37%,2天降低約48%。
孕婦及哺乳期婦女用藥
來氟米特具有生殖毒性,能引起胚胎損傷。小鼠服用15毫克/公斤來氟米特,雄鼠精子畸形率明顯升高,雌鼠吸收胚胎和死亡胚胎率增加,活胚率下降。因此,孕婦及哺乳期婦女禁用。有可能懷孕的孕齡婦女禁用。
兒童用藥
對兒童套用本品的療效和安全性還沒有研究,故年齡小於18歲的患者,建議不使用本品。
老年用藥
慎用。
藥物相互作用
1.消膽胺和活性炭 志願者和患者服用消膽或活性炭時,血液中M1水平顯著下降。
2.肝毒性藥物 來氟米特和肝毒性藥物合用時,不良反應增強。如來氟米特治後,未進行藥物消除就服用肝毒性藥物,也會導致不良反應增強。30例聯合使用來氟米特和氨甲喋呤患者中,有5例患者轉氨酶升高2~3倍,其中2例繼續聯合用藥,另外3例停用來氟米特;另5例轉氨酶升高大於3倍者,其中2例繼續聯合用藥,另外3例停用來氟米特,研究結束10例患者轉氨酶均恢復正常。所有患者均符合ACR肝活組織檢查標準。
3.非甾體類解熱鎮痛藥 體外試驗顯示:M1可使游離雙氯芬酸和布洛芬濃度增加13~50%。但臨床試驗中,非甾體類解熱鎮痛藥與來氟米特合併用藥時,未出現不良反應增強現象。
4.甲苯磺丁脲 體外試驗顯示:M1可使游離甲苯磺丁脲濃度升高13~50%,此臨床意義還不清楚。
5.利福平多劑量利福平和單劑量來氟米特聯合套用,血液中游離M1較單獨使用來氟米特提高40%,隨著利福平的使用,M1濃度可能繼續升高,因此來氟米特和利福平聯合用藥時,要慎重。
2.肝毒性藥物 來氟米特和肝毒性藥物合用時,不良反應增強。如來氟米特治後,未進行藥物消除就服用肝毒性藥物,也會導致不良反應增強。30例聯合使用來氟米特和氨甲喋呤患者中,有5例患者轉氨酶升高2~3倍,其中2例繼續聯合用藥,另外3例停用來氟米特;另5例轉氨酶升高大於3倍者,其中2例繼續聯合用藥,另外3例停用來氟米特,研究結束10例患者轉氨酶均恢復正常。所有患者均符合ACR肝活組織檢查標準。
3.非甾體類解熱鎮痛藥 體外試驗顯示:M1可使游離雙氯芬酸和布洛芬濃度增加13~50%。但臨床試驗中,非甾體類解熱鎮痛藥與來氟米特合併用藥時,未出現不良反應增強現象。
4.甲苯磺丁脲 體外試驗顯示:M1可使游離甲苯磺丁脲濃度升高13~50%,此臨床意義還不清楚。
5.利福平多劑量利福平和單劑量來氟米特聯合套用,血液中游離M1較單獨使用來氟米特提高40%,隨著利福平的使用,M1濃度可能繼續升高,因此來氟米特和利福平聯合用藥時,要慎重。
藥物過量
在小鼠和大鼠急性毒性試驗中,口服來氟米特最小毒性劑量分別為200~500毫克/公斤和100毫克/公斤。如臨床過程中出現藥物過量或毒性反應,建議使用消膽胺和活性炭加速藥物清除。
藥理毒理
藥理作用
來氟米特為具有抗增殖活性的異噁唑類免疫抑制劑,其作用機理主要是抑制二氫乳清酸脫氫酶的活性,從而影響活化淋巴細胞的嘧啶合成。體內、外試驗表明,本品具有抗炎作用。來氟米特的體內活性主要通過其活性代謝產物A771726(下稱M1)而產生。
毒理研究
遺傳毒性:
來氟米特Ames試驗、程式外DNA合成試驗、HGPRT(次黃嘌呤鳥嘌呤磷酸核糖基轉移酶)基因突變試驗結果均為陰性。另外,來氟米特在小鼠微核試驗及中國倉鼠(在體)骨髓細胞試驗中均未出現致染色體畸變作用,而來氟米特的次要代謝物4-三氟甲基苯胺(TFMA)在Ames試驗、HGPRT基因突變試驗和中國倉鼠細胞(體外)染色體畸變試驗中均出現該作用,但TFMA在小鼠微核試驗和中國倉鼠(在體)骨髓細胞遺傳學試驗中均未出現該作用。
生殖毒性:
來氟米特經口給藥劑量高達4.Omg/kg,對雄性和雌性大鼠生育力無影響。
臨床上孕婦服用來氟米特時可引起胎兒損害。懷孕大鼠在器官形成期經口給予來氟米特15mg/kg(按AUC計算,大鼠M1的全身暴露量約為人暴露量的1/10)出現致畸作用,主要表現為無眼或微眼、梗阻性腦積水。在此暴露量下,來氟米特還引起孕鼠體重下降、胎鼠死亡增加及體重下降。懷孕家兔在器官形成期給予來氟米特10mg/kg(按AUC計算,大鼠M1的全身暴露量約等於人的最大暴露量),導致胸骨融合和發育不良。大鼠和家兔在來氟米特1mg/kg劑量下未出現致畸作用。雌性大鼠在交配前14天至哺乳期末給予來氟米特1.25mg/kg(按AUC計算,大鼠M1的暴露量約等於人最大暴露量的1/100),仔鼠的生存率出現明顯(大於90%)的降低。
致癌性:
在大鼠連續2年口服來氟米特達最大耐受劑量6 mg/kg(按AUC計算,約為人M1最大全身暴露量的1/40)的試驗中,末出現致癌作用。
但是,在連續2年經口給予最大劑量15 mg/kg(按AUC計算,約為人M1全身暴露量的的1.7倍)的研究中,雄性小鼠出現淋巴瘤發生率增加,雌性小鼠在1.5mg/kg劑量下(起始劑量,按AUC計算,約為人M1全身暴露量的1/10)出現劑量相關性的支氣管肺泡腺瘤和支氣管肺泡癌發生率增加。以上小鼠研究結果的臨床意義尚不清楚。
來氟米特為具有抗增殖活性的異噁唑類免疫抑制劑,其作用機理主要是抑制二氫乳清酸脫氫酶的活性,從而影響活化淋巴細胞的嘧啶合成。體內、外試驗表明,本品具有抗炎作用。來氟米特的體內活性主要通過其活性代謝產物A771726(下稱M1)而產生。
毒理研究
遺傳毒性:
來氟米特Ames試驗、程式外DNA合成試驗、HGPRT(次黃嘌呤鳥嘌呤磷酸核糖基轉移酶)基因突變試驗結果均為陰性。另外,來氟米特在小鼠微核試驗及中國倉鼠(在體)骨髓細胞試驗中均未出現致染色體畸變作用,而來氟米特的次要代謝物4-三氟甲基苯胺(TFMA)在Ames試驗、HGPRT基因突變試驗和中國倉鼠細胞(體外)染色體畸變試驗中均出現該作用,但TFMA在小鼠微核試驗和中國倉鼠(在體)骨髓細胞遺傳學試驗中均未出現該作用。
生殖毒性:
來氟米特經口給藥劑量高達4.Omg/kg,對雄性和雌性大鼠生育力無影響。
臨床上孕婦服用來氟米特時可引起胎兒損害。懷孕大鼠在器官形成期經口給予來氟米特15mg/kg(按AUC計算,大鼠M1的全身暴露量約為人暴露量的1/10)出現致畸作用,主要表現為無眼或微眼、梗阻性腦積水。在此暴露量下,來氟米特還引起孕鼠體重下降、胎鼠死亡增加及體重下降。懷孕家兔在器官形成期給予來氟米特10mg/kg(按AUC計算,大鼠M1的全身暴露量約等於人的最大暴露量),導致胸骨融合和發育不良。大鼠和家兔在來氟米特1mg/kg劑量下未出現致畸作用。雌性大鼠在交配前14天至哺乳期末給予來氟米特1.25mg/kg(按AUC計算,大鼠M1的暴露量約等於人最大暴露量的1/100),仔鼠的生存率出現明顯(大於90%)的降低。
致癌性:
在大鼠連續2年口服來氟米特達最大耐受劑量6 mg/kg(按AUC計算,約為人M1最大全身暴露量的1/40)的試驗中,末出現致癌作用。
但是,在連續2年經口給予最大劑量15 mg/kg(按AUC計算,約為人M1全身暴露量的的1.7倍)的研究中,雄性小鼠出現淋巴瘤發生率增加,雌性小鼠在1.5mg/kg劑量下(起始劑量,按AUC計算,約為人M1全身暴露量的1/10)出現劑量相關性的支氣管肺泡腺瘤和支氣管肺泡癌發生率增加。以上小鼠研究結果的臨床意義尚不清楚。
藥代動力學
以下資料根據文獻報導:
動物實驗顯示:大鼠與比格犬單次口服來氟米特後,測其活性代謝產物A771726(M1)的血液濃度-時間曲線均符合二房室模型:t1/2為12.Ooh-14.70h;Tmax為1.93h-5.3h。小鼠口服來氟米特後,很快吸收並轉化為活性代謝產物A771726(M1),分布於全身各組織中,其中血含量最高,其餘依次為肝、胃、腸、腎、肺、心、脾、睪丸、肌肉和腦。來氟米特在大鼠體內轉化為代謝產物A771726(M1)主要由糞便排出,少量由尿液、膽汁排出。
另據文獻報導:來氟米特吸收進入人體後,迅速成為活性代謝產物A771726(M1)來發揮藥理作用,偶爾能夠在血漿中檢測到低水平的來氟米特,因而來氟米特藥代動力學研究是通過檢測M1濃度變化來完成。
吸收:口服來氟米特後,6-12小時之間M1達到峰值。M1半衰期較長,臨床中若起始劑量為100毫克,連續3天,有助於M1快速達到穩態濃度,否則M1需要2個月才能達到穩態。不同來氟米特起始/維持劑量試驗表明,血漿中M1水平呈劑量相關性。來氟米特片生物利用度為80%,高脂飲食對M1血漿濃度沒有顯著影響。
分布:M1主要分布於肝、腎和皮膚組織,而腦組織中分布較少。健康志願者M1分布容積較低(0.13升/毫克),超過99.3%的M1與白蛋白結合,蛋白結合量與治療濃度呈線性相關。類風濕性關節炎患者游離M1數量增加,慢性腎衰患者游離M1增加近1倍,其機制尚不清楚。
代謝:來氟米特進入血液後,迅速代謝成為M1,原型藥物很難檢測得到。此外,來氟米特還有許多次要代謝產物,但僅有三氟甲基苯胺(TFMA)以低水平出現在某些患者血液中並可被定量。來氟米特代謝的確切臟器尚不清楚,體內外試驗表明,胃腸壁和肝臟可能在這一過程中發揮作用。尚未發現來氟米特的特異性代謝酶,僅確定代謝過程在肝細胞質和微粒體中發生。
消除:活性代謝物M1進一步代謝後經腎臟排泄,M1也可直接通過膽汁排泄。單劑量注射放射性標記的來氟米特後,連續觀察28天,近43%的總放射活性通過尿液清除,48%的總放射活性通過糞便清除。進一步分析表明,尿液中主要是葡萄糖苷酸和M1的苯胺羰酸衍生物,糞便中主要是M1;最初96小時內腎臟是主要清除途徑,然後糞便成為主要清除途徑。靜脈注射M1,清除速率估計在31毫升/小時。口服活性炭或消膽胺可促進藥物消除,使M1半衰期由大於1周,降為不足1天,這表明腸肝循環是M1半衰期較長的主要因素。血液透析和連續活動性腹膜透析試驗表明,M1不能被透析。
動物實驗顯示:大鼠與比格犬單次口服來氟米特後,測其活性代謝產物A771726(M1)的血液濃度-時間曲線均符合二房室模型:t1/2為12.Ooh-14.70h;Tmax為1.93h-5.3h。小鼠口服來氟米特後,很快吸收並轉化為活性代謝產物A771726(M1),分布於全身各組織中,其中血含量最高,其餘依次為肝、胃、腸、腎、肺、心、脾、睪丸、肌肉和腦。來氟米特在大鼠體內轉化為代謝產物A771726(M1)主要由糞便排出,少量由尿液、膽汁排出。
另據文獻報導:來氟米特吸收進入人體後,迅速成為活性代謝產物A771726(M1)來發揮藥理作用,偶爾能夠在血漿中檢測到低水平的來氟米特,因而來氟米特藥代動力學研究是通過檢測M1濃度變化來完成。
吸收:口服來氟米特後,6-12小時之間M1達到峰值。M1半衰期較長,臨床中若起始劑量為100毫克,連續3天,有助於M1快速達到穩態濃度,否則M1需要2個月才能達到穩態。不同來氟米特起始/維持劑量試驗表明,血漿中M1水平呈劑量相關性。來氟米特片生物利用度為80%,高脂飲食對M1血漿濃度沒有顯著影響。
分布:M1主要分布於肝、腎和皮膚組織,而腦組織中分布較少。健康志願者M1分布容積較低(0.13升/毫克),超過99.3%的M1與白蛋白結合,蛋白結合量與治療濃度呈線性相關。類風濕性關節炎患者游離M1數量增加,慢性腎衰患者游離M1增加近1倍,其機制尚不清楚。
代謝:來氟米特進入血液後,迅速代謝成為M1,原型藥物很難檢測得到。此外,來氟米特還有許多次要代謝產物,但僅有三氟甲基苯胺(TFMA)以低水平出現在某些患者血液中並可被定量。來氟米特代謝的確切臟器尚不清楚,體內外試驗表明,胃腸壁和肝臟可能在這一過程中發揮作用。尚未發現來氟米特的特異性代謝酶,僅確定代謝過程在肝細胞質和微粒體中發生。
消除:活性代謝物M1進一步代謝後經腎臟排泄,M1也可直接通過膽汁排泄。單劑量注射放射性標記的來氟米特後,連續觀察28天,近43%的總放射活性通過尿液清除,48%的總放射活性通過糞便清除。進一步分析表明,尿液中主要是葡萄糖苷酸和M1的苯胺羰酸衍生物,糞便中主要是M1;最初96小時內腎臟是主要清除途徑,然後糞便成為主要清除途徑。靜脈注射M1,清除速率估計在31毫升/小時。口服活性炭或消膽胺可促進藥物消除,使M1半衰期由大於1周,降為不足1天,這表明腸肝循環是M1半衰期較長的主要因素。血液透析和連續活動性腹膜透析試驗表明,M1不能被透析。
貯藏
遮光,密封,於陰涼處保存。
包裝
包裝材料:雙鋁
包裝規格:10片/盒、20片/盒、30片/盒。
包裝規格:10片/盒、20片/盒、30片/盒。
有效期
暫定24個月。
執行標準
《中國藥典》2010年版二部
批准文號
國藥準字H20050175
生產企業
福建匯天生物藥業有限公司
核准日期
2006年12月29日
修訂日期
2011年06月07日
