基本介紹
- 是否納入醫保:是
- 商品名:佳羅華
- 英文:Gazyva
- 通用名:奧妥珠單抗注射液
- 英文名:Obinutuzumab Injection
- 生產廠商:Roche Diagnostics GmbH
成分,性狀,規格,中國獲批適應症,用法用量,指南推薦,臨床試驗,藥理作用,藥物相互作用,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,醫保信息,包裝,劑型,貯藏,有效期,藥品上市許可持有人,
成分
活性成份:奧妥珠單抗
奧妥珠單抗注射液系由中國倉鼠卵巢(CHO)細胞表達製備的人源化、糖基工程化抗
CD20 單克隆抗體(IgG1/κ型)。
輔料:L-組氨酸、L-組氨酸鹽酸鹽一水合物、海藻糖二水合物、泊洛沙姆 188
性狀
透明、無色至略帶褐色的溶液
規格
1000 mg(40 ml)/瓶
中國獲批適應症
本品與化療聯合,用於初治的 II 期伴有巨大腫塊、III 期或 IV 期濾泡性淋巴瘤成人患者,達到至少部分緩解的患者隨後用奧妥珠單抗維持治療。
用法用量
一般信息
如需用其他生物製品替換奧妥珠單抗,應事先獲得處方醫師同意。
奧妥珠單抗應通過專用輸液管靜脈輸注給藥,並應在配備完善的急救復甦設施的情況下由至少一名經驗豐富的醫生密切監督使用。奧妥珠單抗輸注不應以靜脈推注的方式給藥,應使用 0.9%氯化鈉溶液作為輸注溶媒(見使用、操作和處置的特殊說明)。
腫瘤溶解綜合徵(TLS)的預防及用藥:
腫瘤負荷高和/或腎功能受損(CrCl <70 mL/min)的患者存在TLS 風險,應接受預防性治療。依據標準操作指南,開始奧妥珠單抗輸注前的預防性治療應包括充分水化和給予抑制尿酸的藥物(例如別嘌醇)或尿酸氧化酶(例如拉布立酶)等適用的替代藥物(見【注意事項】)。如果醫生認為有必要,患者應在後續每次輸注前繼續接受預防性治療。
輸液相關反應(IRR)的預防及用藥
表1列出了降低輸液相關反應風險的預防藥物(見【注意事項】)。
在奧妥珠單抗靜脈輸注過程中IRR 的可能症狀包括低血壓。因此,在每次奧妥珠單抗輸注前12小時以及輸注期間和輸注後1小時內,應考慮暫停使用降壓藥(見【注意事項】)。

輸液相關反應(IRR)的預防及用藥
標準劑量
奧妥珠單抗的推薦劑量為靜脈給予 1000 mg,如表 2 所示。
對於初治的濾泡性淋巴瘤患者,奧妥珠單抗應按如下方式與化療聯合給藥:
● 6 個周期,每個周期 28 天,與苯達莫司汀聯合給藥 ,或
● 6 個周期,每個周期 21 天,與 CHOP 聯合給藥,然後增加 2 個周期的奧妥珠單抗單藥治療,或
● 8 個周期,每個周期 21 天,與CVP 聯合給藥。
經過最初 6 或 8 個周期奧妥珠單抗與化療的聯合治療,達到完全或部分緩解的患者應繼
續接受奧妥珠單抗(1000 mg)單藥維持治療,每 2 個月 1 次,直至疾病進展或最長達 2 年。
單藥維持治療在誘導治療期最後一次奧妥珠單抗給藥後大約 2 個月開始。
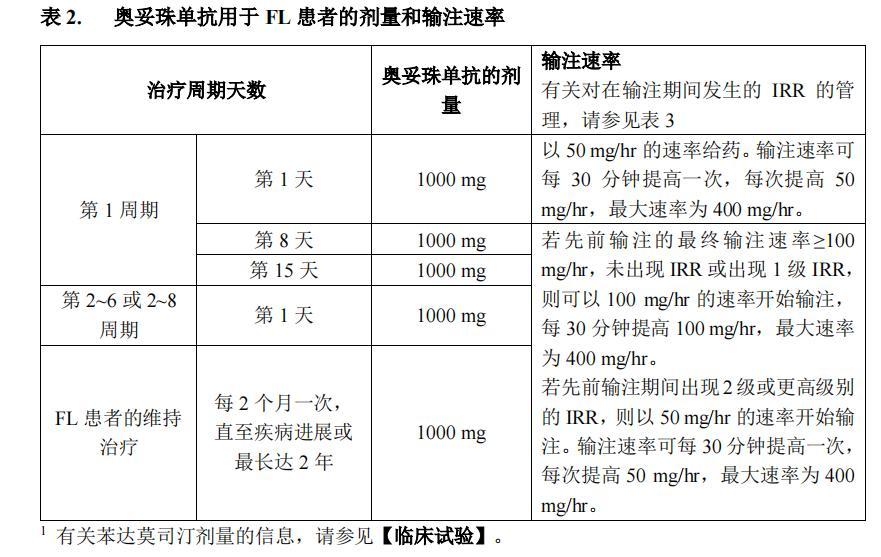
奧妥株單抗用於FL患者的劑量盒輸注速率
延遲或遺漏給藥
如果計畫的奧妥珠單抗用藥出現遺漏,應儘快給藥;不要跳過該次給藥或等到下一次計畫的給藥時間。
如果在第1周期的第8天或第1周期的第15天之前發生了毒性反應,則需要延遲給藥,應在毒性反應恢復後給予這些劑量。在這種情況下,所有後續訪視和第2周期的開始均將根據第1周期中的延遲情況進行調整。在奧妥珠單抗和化療聯合治療期間,調整給藥計畫時應保持化療周期之間的時間間隔。
在維持治療期間,後續給藥依照原定方案給藥。治療期間的劑量調整不建議降低奧妥珠單抗的劑量。
對於不良事件的症狀(包括IRR)管理,請參見下表3和【注意事項】。

針對輸液相關反應的輸注速率調整指南
特殊人群
肝功能不全:尚未確立奧妥珠單抗在肝功能受損患者中的安全性和有效性。腎功能不全在輕度或中度腎功能受損患者中(CrCl 30-89mL/min),無需進行劑量調整。尚未在 CrCl<30mL/min 的患者中對奧妥珠單抗的安全性及有效性進行研究(參見【腎功能受損患者】和【藥代動力學】特殊人群中的藥代動力學)。
老年人:在年齡≥ 65 歲的患者中不建議進行劑量調整(參見【老年用藥】)。兒童尚未確立奧妥珠單抗在 18 歲以下患者中的安全性和有效性。
指南推薦
2021年10月,中國臨床腫瘤學會(CSCO)淋巴瘤專家委員會發布的《奧妥珠單抗臨床用藥指導原則中國專家共識(2021年版)》指出:多項臨床研究顯示奧妥珠單抗聯合化療用於初治或復發難治濾泡性淋巴瘤,或用於初治慢性淋巴細胞白血病,可有效降低疾病進展風險,改善患者預後。
臨床試驗
佳羅華在中國的本次的獲批基於全球III期GALLIUM研究 ,研究結果表明:經過34.5個月中位隨訪觀察,相比對照組,佳羅華聯合化療方案可使進展/復發或死亡風險顯著降低34%,無進展生存期獲得顯著延長(三年PFS率為80.0% vs. 73.3%,HR=0.66;95% CI: 0.51-0.85;p=0.0012),達到主要研究終點 。
在濾泡性淋巴瘤的早期進展方面,佳羅華聯合化療方案可使24個月內病情進展(POD24)事件累計發生比例大幅下降,早期進展風險降低46%(9% vs. 16%,HR=0.54;95% CI: 0.39-0.75)。
此外,安全性方面數據證實,奧妥珠單抗治療方案的套用情況與既往已知安全性數據一致,未發現新的或未預期的安全性信號。
藥理作用
奧妥珠單抗為單克隆抗體,靶向於前 B 淋巴細胞和成熟B 淋巴細胞表面表達的CD20 抗原。與CD20 抗原結合後,奧妥珠單抗通過以下機制介導B 細胞溶解:(1)募集免疫效應細胞;(2)直接激活細胞內死亡信號通路(直接細胞死亡);和/或(3)補體激活級聯反應。免疫效應細胞機制包括抗體依賴性細胞介導的細胞毒性( ADCC)和抗體依賴性細胞吞噬(ADCP)。
作為一種岩藻糖含量減少的抗體,奧妥珠單抗在人腫瘤細胞系體外試驗中可誘導產生較利妥昔單抗更強的ADCC 效應。奧妥珠單抗誘導細胞直接死亡的活性也比利妥昔單抗更強。奧妥珠單抗對 FcɣRIII 受體蛋白的親和力較利妥昔單抗更強。奧妥珠單抗和利妥昔單抗對 CD20上的重疊表位具有相似的親和力。
藥物相互作用
儘管已經對奧妥珠單抗與苯達莫司汀、CHOP(環磷醯胺、多柔比星、長春新鹼、潑尼松龍)、FC(氟達拉濱、環磷醯胺)和苯丁酸氮芥進行了有限的藥物相互作用子研究,但尚未進行正式的藥物-藥物相互作用研究。與奧妥珠單抗合併給藥對苯達莫司汀、FC 或CHOP的每種化療藥物藥代動力學沒有影響;此外,苯達莫司汀、FC、苯丁酸氮芥或 CHOP 對奧妥珠單抗的藥代動力學沒有明顯影響。不能排除與伴隨使用的藥物發生相互作用的風險。
注意事項
輸液相關反應(IRR)
奧妥珠單抗治療患者中最常見的藥物不良反應(ADR)是輸液相關反應,主要發生在首個 1000 mg 劑量的輸注期間。IRR 可能與細胞因子釋放綜合徵有關,奧妥珠單抗治療患者中也有相關報告。必須遵循減少IRR 的緩解措施(見【用法用量】)。輸液相關症狀的發生率和嚴重程度在第一次 1000 mg 劑量輸注後會明顯降低,大部分患者在奧妥珠單抗後續給藥期間不再發生IRR(見【不良反應】)。
在大多數患者中,無論適應症,輸液相關反應均為輕度至中度,而且可以通過減慢或暫停首次輸液來控制,但是同時也報告了需要對症治療的重度和危及生命的輸液相關反應。在臨床上,可能難以區分IRR 和 IgE 介導的過敏反應(例如,速發過敏反應)。高腫瘤負荷的患者發生重度IRR 風險增加。腎功能不全患者(CrCl<50mL/min)IRR 發生風險更高,包括重度IRR 有關預防性治療的信息,請參見【用法用量】;有關如何基於反應級別管理 IRR 的信息,請參見表 3 針對輸液相關反應的輸注速率調整指南。
如果出現以下情況,患者不得接受進一步的奧妥珠單抗輸註:

輸液相關反應(IRR)
應在整個輸注期間及輸注後對伴有心臟病或肺病的患者進行密切監測。奧妥珠單抗靜脈輸注過程中可能會出現低血壓,因此,在每次奧妥珠單抗輸注前 12 小時以及輸注期間和輸注後 1 小時內,應考慮暫停使用降壓藥。對於有急性高血壓危象風險的患者,應評價其停用降壓藥的獲益和風險。
超敏反應
在接受奧妥珠單抗治療的患者中曾報告過速發(例如,速發過敏反應)和延遲發作的(例如,血清病)超敏反應。臨床上可能難以鑑別超敏反應與輸液相關反應,超敏反應症狀一般出現在既往暴露之後,而且首次輸注時非常罕見。如果在輸注過程中或輸注後疑似出現超敏反應,則應停止輸注,並永久終止治療。已知對奧妥珠單抗有超敏反應的患者不得接受治療(見【禁忌】)。
腫瘤溶解綜合徵(TLS)
已報告使用奧妥珠單抗後可發生腫瘤溶解綜合徵(TLS)。被認為有 TLS 風險的患者 [例如,腫瘤負荷高和/或腎功能受損(CrCl <70 mL/min)患者] 應接受預防性治療。如在【用法用量】中所述,預防治療應在奧妥珠單抗給藥前的 12-24 小時內開始,包括充分水化和給予抑制尿酸的藥物(例如,別嘌醇)或尿酸氧化物(例如,拉布立酶)等適用的替代藥物。在最初幾天的治療期間應仔細監測認為有風險的所有患者,特別關注腎功能、鉀和尿酸值。應遵循符合規範的其他任何指導原則。TLS 的治療包括糾正電解質異常、監測腎功能和液體平衡以及給予支持治療,包括根據需要進行透析。
中性粒細胞減少症
已報告在接受奧妥珠單抗治療期間可出現重度和危及生命的中性粒細胞減少症,包括發熱性中性粒細胞減少症。應通過定期實驗室檢查密切監測出現中性粒細胞減少症的患者直至恢復。如有必要進行治療,應當按照當地的指南考慮給予粒細胞集落刺激因子(G-CSF)。任何跡象顯示伴隨感染即應給予相應治療。嚴重或危及生命的中性粒細胞減少症應考慮延遲奧妥珠單抗給藥。強烈建議重度中性粒細胞減少症持續超過 1 周的患者在治療期間接受預防
性抗菌治療直至恢復至 1 或 2 級,抗病毒和抗真菌也應考慮。可能會發生遲發性(在治療結束後 28 天后發生)或持續性中性粒細胞減少症(在治療完成/停用後,持續超過 28 天)。腎功能損傷患者(CrCl<50mL/min)發生中性粒細胞減少症風險增加。
血小板減少症
在奧妥珠單抗治療期間,曾觀察到重度和危及生命的血小板減少症,包括急性血小板減少症(發生在輸注後的 24 小時內)。腎功能損傷患者(CrCl<50mL/min)發生血小板減少症風險增加。在血小板減少症與出血事件之間,尚未確立明確的關係。
應密切監測患者是否發生血小板減少症,特別是在第 1 周期期間;應定期進行實驗室檢查直到恢復,如果發生重度或危及生命的血小板減少症,應考慮延遲給藥。主治醫生可酌情依據機構的臨床實踐給予血液製品輸注(即血小板輸注)。任何可能加重血小板減少症相關事件的伴隨用藥,例如血小板抑制劑和抗凝劑,都應慎用,特別是在第 1 周期期間。
既有心臟疾病加重
在有基礎心臟疾病的患者中,已經報告了在接受奧妥珠單抗治療期間發生心律失常(如房顫和快速性心律失常)、心絞痛、急性冠脈綜合徵、心肌梗死和心力衰竭(見【不良反應】)。這些事件可能表現為IRR 的部分症狀,並且可能致死。因此,應當密切監測有心臟病史的患者。此外,這些患者應謹慎水化,以防止可能出現的液體過多。
感染不應在有活動性感染的情況下給予奧妥珠單抗,對於有反覆感染或慢性感染史的患者,應慎用奧妥珠單抗。奧妥珠單抗治療期間以及治療結束後可能發生嚴重的細菌性、真菌性,以及新發病毒性感染或病毒再激活性感染。曾有過致死性感染的報告。
在 FL 研究中,包括隨訪期在內的所有研究階段均觀察到感染髮生率升高,其中在維持階段觀察到的感染髮生率最高。隨訪期間,在誘導期接受了奧妥珠單抗+苯達莫司汀治療的患者中觀察到了更多的3~5級感染。
B型肝炎病毒再激活
接受抗 CD20 抗體(包括奧妥珠單抗)治療的患者,可能會發生B型肝炎病毒(HBV)再激活,某些情況下會導致暴發性肝炎、肝功能衰竭和死亡(見【不良反應】)。
開始奧妥珠單抗治療之前,應該在所有患者中進行B型肝炎病毒(HBV)篩查, 至少應包括HBsAg 和HBcAb 檢查。可以根據當地指導原則適當補充檢測其他標誌物。活動性B型肝炎患者不應該接受奧妥珠單抗治療。在治療開始之前,血清學陽性的B型肝炎患者應諮詢肝病專家,並且應按照當地醫療規範接受監測和管理,以預防肝炎病毒再激活。
進行性多灶性腦白質病(PML)
在接受奧妥珠單抗治療的患者中有發生 PML 的報告(見【不良反應】)。當任何患者出現新發神經系統症狀或原有神經系統表現改變時,均應考慮PML 診斷。PML 的症狀不具有特異性,隨著腦受累區域的不同而有所差異。常見皮質脊髓束受損的運動症狀(例如,肌無力、癱瘓和感覺障礙)、感覺異常、小腦症狀和視野缺損。可能會發生“皮質性”的體徵/症狀(例如,失語症或視覺-空間定向障礙)。PML 的評估包括但不限於,神經科專家會診、腦磁共振成像(MRI)和腰椎穿刺術(腦脊液JC 病毒 DNA 檢測)。奧妥珠單抗治療應在可疑PML 檢查期間暫停,且在確認為 PML 後永久停藥。所有合併使用的化療或免疫抑制治療也應考慮停用或減量。應將患者轉診至神經科專家處進行PML 的評估和治療。
免疫接種
尚未研究奧妥珠單抗治療後接種活病毒疫苗或減毒疫苗的安全性,因此不建議在治療期間以及B 細胞恢復前接種活病毒疫苗。
奧妥珠單抗宮內暴露與使用活病毒疫苗進行嬰兒疫苗接種:在妊娠期間曾接受過奧妥珠單抗治療的母親所生育的嬰兒中可能會出現 B 細胞耗竭,應監測嬰兒 B 細胞耗竭情況,並推遲活病毒疫苗的接種,直至嬰兒的 B 細胞計數恢復。應與嬰兒的醫生討論接種活病毒疫苗的安全性和時間安排。(見【孕婦及哺乳期婦女用藥】,妊娠期)。
腎功能受損患者
在 iNHL 患者的關鍵研究中,分別有 6.9%的患者(GAO4753g:14/204 例)和 5%的患者(BO21223:35/698 例)伴有中度腎功能受損(CrCl < 50 mL/min)。這些患者發生的嚴重不良事件、3~5 級不良事件和導致終止治療的不良事件(僅研究 BO21223 中的患者)多於那些 CrCl ≥ 50 mL/min 的患者(見特殊劑量指導和特殊人群中的藥代動力學)。研究排除了 CrCl < 40 mL/min 的患者(見【臨床試驗】。
駕駛和操作機器的能力
尚未開展過有關奧妥珠單抗對駕駛和機械操作能力影響的研究。對於出現輸液相關症狀的患者,建議在症狀消退之前,不要駕駛和操作機器。
孕婦及哺乳期婦女用藥
妊娠:
應避免在妊娠期間使用奧妥珠單抗,除非對母親的潛在獲益超過對胎兒的潛在風險。對於在妊娠期間曾接受過奧妥珠單抗治療的母親所生育的嬰兒,應考慮推遲減毒活疫苗的接種,直至嬰兒的B細胞水平在正常範圍內。
尚未在妊娠女性中進行過研究。動物試驗參見【藥理毒理】,生殖毒性。
分娩:無可報告的數據。
哺乳:由於IgG 能分泌至母乳中,而且尚不清楚嬰兒吸收的可能性和對嬰兒的危害,應該建議哺乳女性在奧妥珠單抗治療期間和在奧妥珠單抗末次給藥之後 18 個月內停止哺乳(見【藥代動力學】,消除)。動物研究已經顯示了奧妥珠單抗能分泌至乳汁中(見【藥理毒理】,生殖毒性)。
避孕:有生育能力的女性在奧妥珠單抗治療期間和在奧妥珠單抗治療之後 18 個月內應使用有效的避孕措施(見【藥代動力學】,消除)。
兒童用藥
尚未確立奧妥珠單抗在 18 歲以下患者中的安全性和有效性。
老年用藥
在 iNHL 患者的關鍵研究中,年齡為 65 歲或以上的患者發生的嚴重不良事件和導致退出或死亡的不良事件多於年齡< 65 歲的患者。在有效性方面未觀察到顯著臨床差異。
醫保信息
2021年12月,佳羅華(奧妥珠單抗)被正式納入《國家基本醫療保險、工傷保險和生育保險藥品目錄(2021版)》,醫保適應症為:與化療聯合用於初治的II期伴有巨大腫塊、III期或IV期濾泡性淋巴瘤(FL)成人患者,以及達到至少部分緩解的患者隨後的單藥維持治療。
包裝
西林瓶裝:1 瓶/盒
劑型
注射劑
貯藏
於 2 ~8°C 避光貯存和運輸,不得冷凍,請勿振搖。
將瓶裝製劑留存在外包裝箱中避光保存。
不得在包裝上所標示的有效期(EXP)後使用本品。
有效期
36個月
藥品上市許可持有人
Roche Pharma (Schweiz) AG
