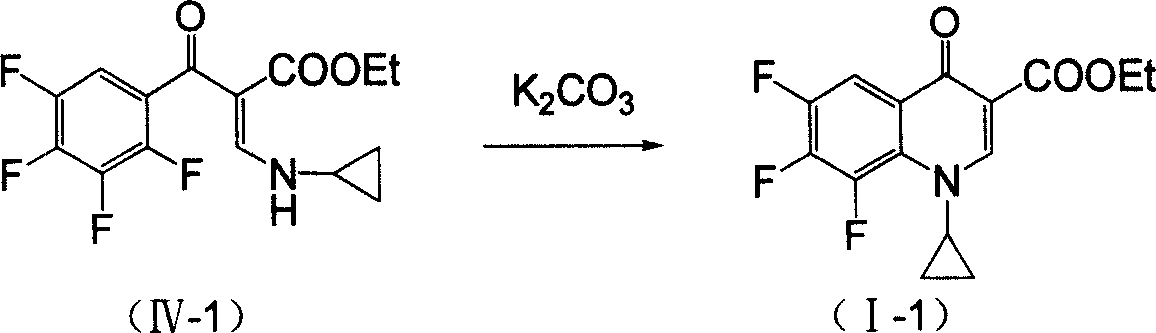專利背景
喹諾酮類藥物自其問世以來就一直發展迅速,翻開了繼
磺胺類藥物之後全合成
抗感染藥物的新篇章。2007年前已成為抗細菌感染的主要藥物之一,廣泛用於治療各種感染,對
敏感菌所致感染的治癒率的提高、危重感染病死率的降低起了重要作用。
喹諾酮主環化合物的合成是製備喹諾酮類原料藥及關鍵中間體的共性技術,也是制約其發展的瓶頸,科學界一直未停止過對步驟短、三廢排放少的喹諾酮主環的合成新方法研究的努力。中國2007年2月之前的產業化的合成方法均為傳統的5步法,2007年前國際上有德國拜耳公司的3步法專利。
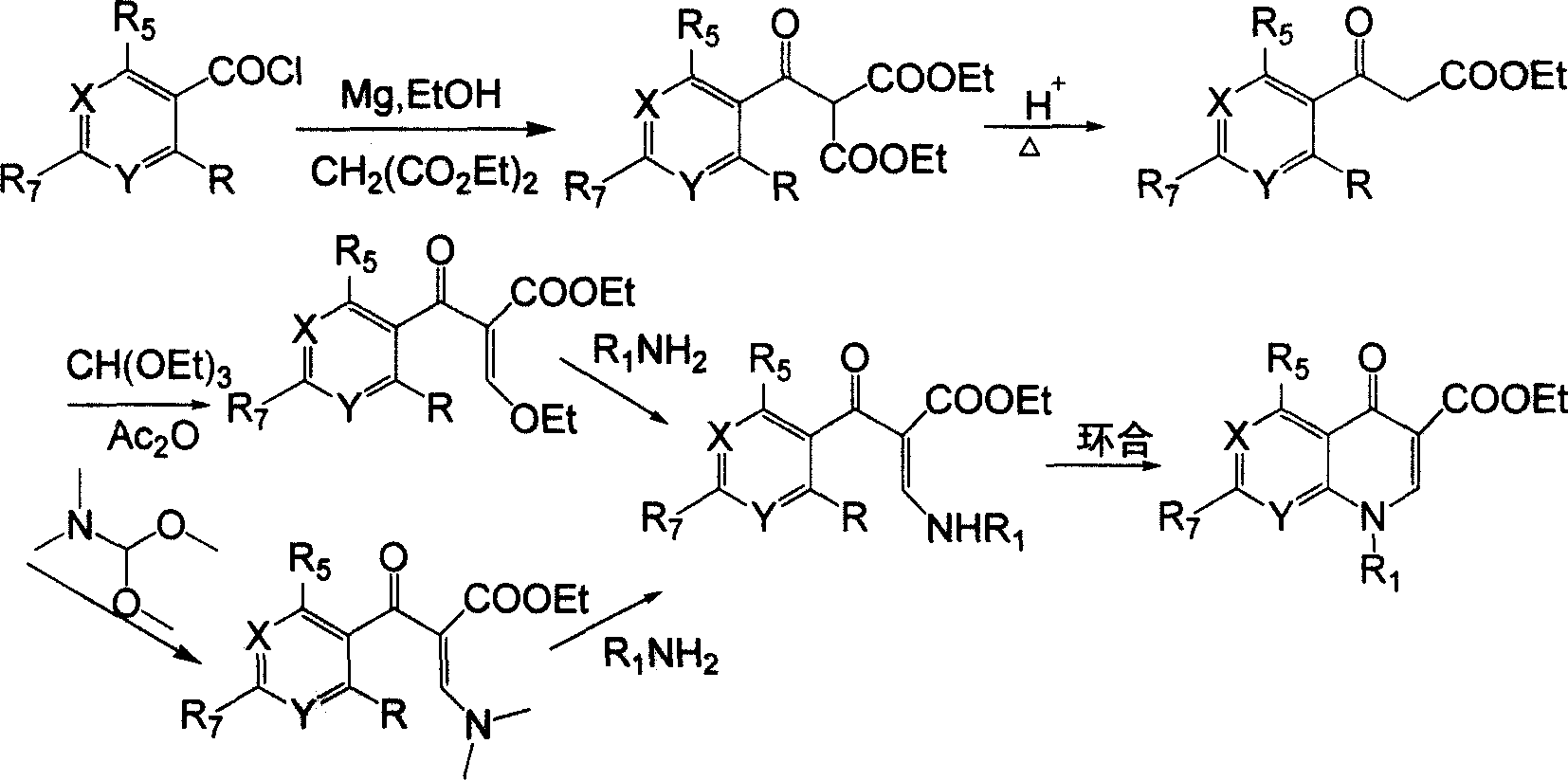
1、中國2007年2月之前的工藝路線:
上述工藝存在著反應步驟較長(5步)、原子經濟性差、脫羧及格氏反應時副產物多、產品分離難、三廢排放量大,且需使用NaH、原甲酸三乙酯等安全隱患較大的原料等缺點。
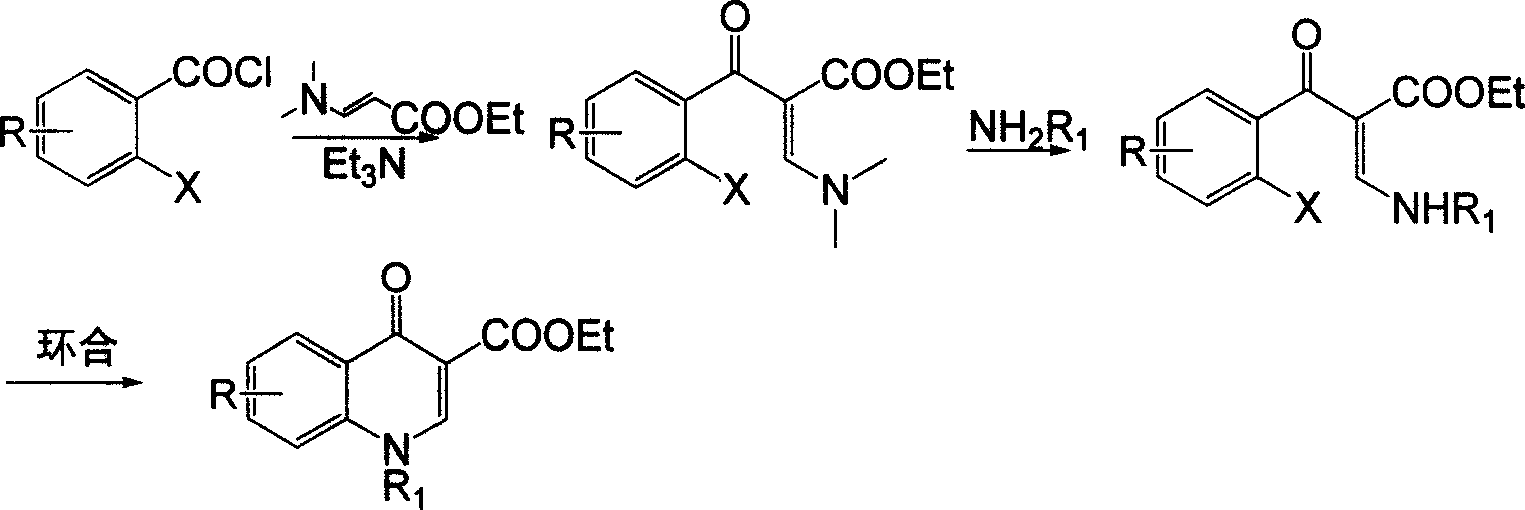
2、中國國外最新專利(德國拜耳公司)的工藝(US6229017):
該工藝使用N,N-二甲氨基丙烯酸乙酯先經胺化反應,再經胺交換,最後芳環化製得喹諾酮主環,該方法改善了上述中國2007年2月之前的路線方法的缺陷,減少了三廢的排放,但該工藝採用二甲胺作為保護劑,原料的利用率仍較低,且脫保護時產生的
二甲胺對大氣的影響較大。
發明內容
專利目的
該發明即是為了提供一種成本低、工藝合理、原子經濟性高、三廢排放量少的喹諾酮主環化合物的合成方法。
技術方案
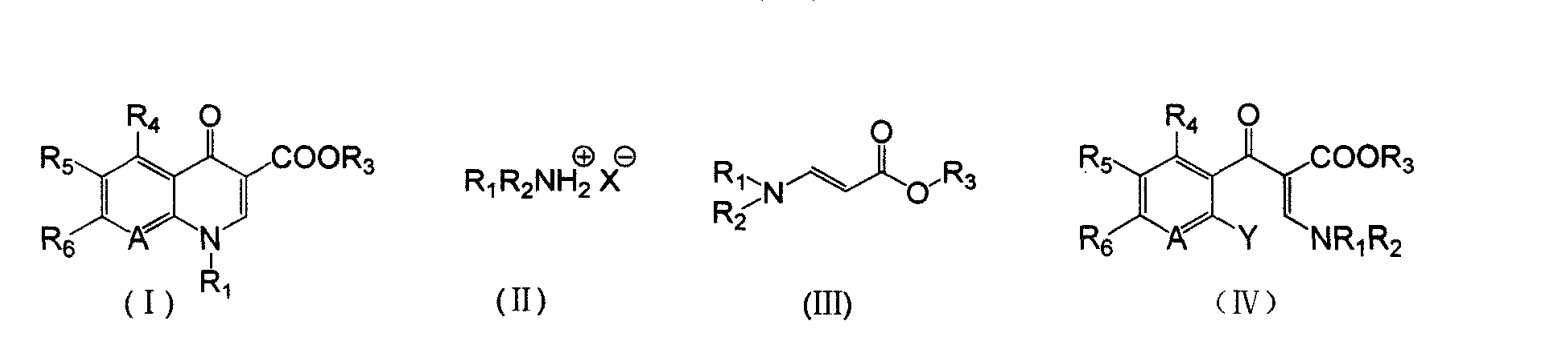
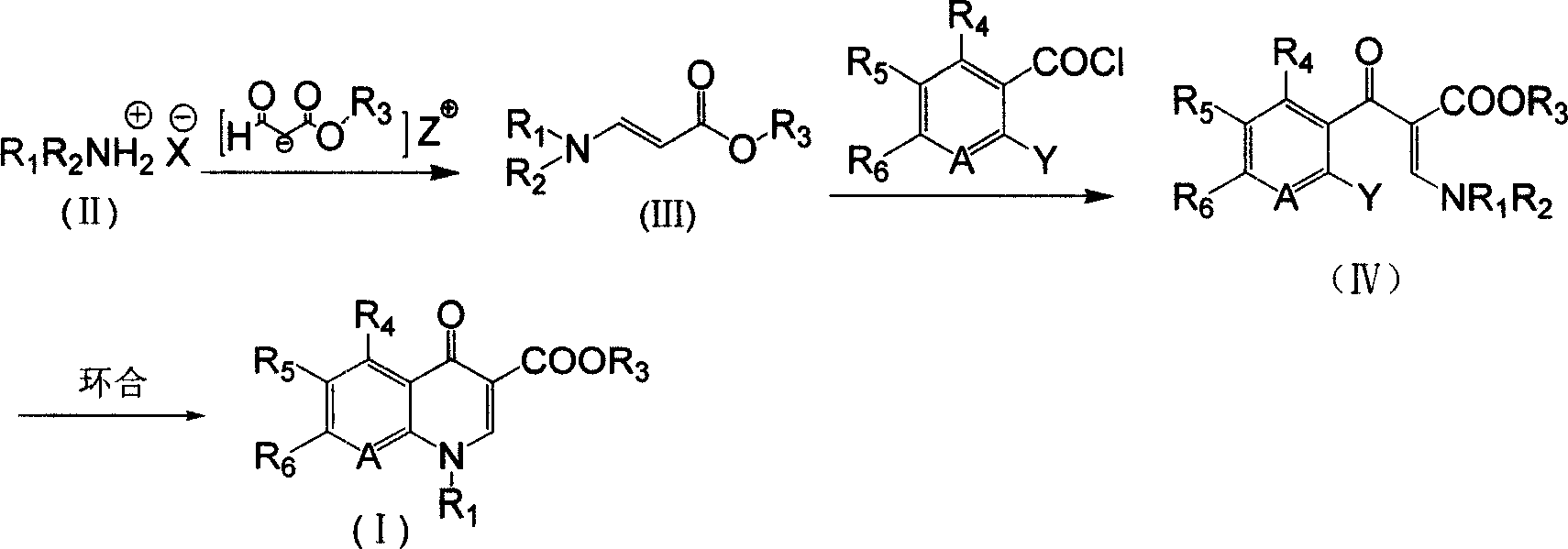
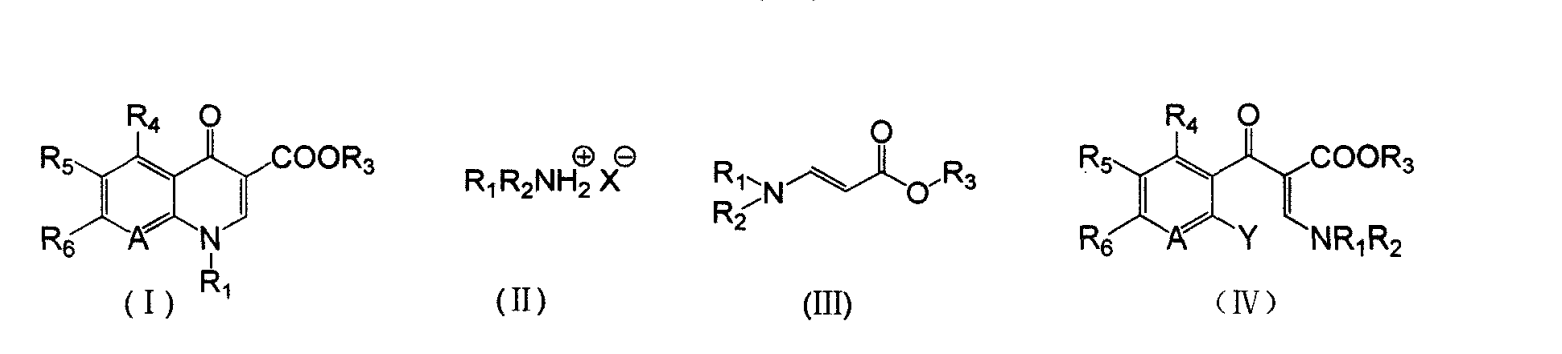
《喹諾酮主環化合物的合成方法》所述方法如下:(1)式(II)所示的銨鹽與甲醯基乙酸酯鹼金屬鹽( Z為鹼金屬)在有機溶劑1中進行胺化反應得到β-取代氨基丙烯酸酯(III),然後再與鄰鹵芳醯氯進行偶聯反應得到式(IV)所示的α-取代芳醯基-β-取代氨基丙烯酸酯;(2)所述α-取代芳醯基-β-取代氨基丙烯酸酯(IV)再經環合反應得到所述的喹諾酮主環化合物(I);
式(I)、(II)、(III)、(IV)中:R1和R2各自獨立為H,或C1~C4的烷基,或C3~C6的環烷基,或芳基,或與N相連的飽和或不飽和的帶不多於2個雜原子的五元環或六元環,雜原子為O、S或SO2;R3為1~4個碳原子的烷基或H;R4、R5、R6各自獨立為H,或鹵素,或硝基,或氨基,或1-取代環丙烷基,或取代或不取代的哌嗪基,或取代或不取代的吡咯基;X為無機酸或有機酸的陰離子;Y為鹵素、-SCH3、-SO2CH3或硝基;A為N或C-R7,R7為H、-CH3、-OCH3、鹵素、硝基或氰基,或與R1連線成環。
所述無機酸或有機酸為下列之一:無機酸:HF,HCl,HBr,H2SO4,HNO3,H3PO4,H2CO3等;有機酸:1)低碳酸:甲酸,乙酸,丙酸,丁酸等;2)鹵代低碳酸:氯乙酸,二氯乙酸,三氯乙酸,三氟乙酸等;3)磺酸:甲磺酸,苯磺酸,甲苯磺酸等。優選為HCl或H2SO4。
具體的,所述步驟(2)為:式(IV)所示的α-取代芳醯基-β-取代氨基丙烯酸酯於有機溶劑2中、在縛酸劑存在下,於30~220℃下反應時間5~8小時,反應結束後,反應液經分離純化得到所述的喹諾酮主環化合物,所述縛酸劑為路易斯鹼,所述α-取代芳醯基-β-取代氨基丙烯酸酯與縛酸劑物質的量之比為1:0.5~3,所述的有機溶劑2的用量以能使反應物分散均勻為宜,一般為化合物(IV)質量的1~8倍。
所述步驟(1)中鄰鹵芳醯氯、甲醯基乙酸酯鹼金屬鹽、銨鹽物質的量之比為1:1~1.5:1~2,更優選為1:1:1,所述的有機溶劑1用量為能使反應物分散均勻、並順利回流為宜,一般質量為甲醯基乙酸酯鹼金屬鹽的1.2~10倍。所述步驟(1)中胺化反應溫度為-10~120℃。所述步驟(1)中偶聯反應溫度為5~100℃。所述有機溶劑1、有機溶劑2各自獨立為下列之一或其中兩種或兩種以上的混合物:①烷基苯,②鹵代苯,③烷基鹵代苯,④脂環烴。
所述有機溶劑1為下列之一:1)烷基苯,特別是每個苯環上有0~3個的1~4個碳原子取代基的烷基苯,如苯、甲苯、二甲苯;2)鹵代苯,特別是每個苯環上有1~2個鹵原子取代的鹵代苯,如氯苯;3)烷基鹵代苯,特別是每個苯環上有1~2個的1~4個碳原子取代基和1~2個鹵原子取代基的鹵代苯;4)脂環烴,特別是有0~2個的1~4個碳原子的、開環的、飽和或不飽和烴取代基的五~七元環,如環己烷;5)上述任一混合溶劑;6)鹵代烷,如CH2Cl2、CHCl3、CCl4;7)鏈烴,如戊烷、己烷、庚烷、或者主要成分為戊烷和己烷的石油醚;8)醇類,如甲醇、乙醇、異丙醇、環己醇、丁二醇;9)酯類,如乙酸乙酯、乙酸丁酯;10)醚類,如異丙醚、乙醚、四氫呋喃(THF);11)酮類,如丙酮、丁酮、N-甲基吡咯烷酮;12)極性溶劑如N,N-二甲基甲醯胺(DMF)、二甲基亞碸(DMSO)、乙腈等。
所述有機溶劑2為下列之一:1)烷基苯,特別是每個苯環上有0~3個的1~4個碳原子取代基的烷基苯,如苯、甲苯、二甲苯;2)鹵代苯,特別是每個苯環上有1~2個鹵原子取代的鹵代苯,如氯苯;3)烷基鹵代 苯,特別是每個苯環上有1~2個的1~4個碳原子取代基和1~2個鹵原子取代基的鹵代苯;4)脂環烴,特別是有0~2個的1~4個碳原子的、開環的、飽和或不飽和烴取代基的五~七元環,如環己烷;5)上述任一混合溶劑;6)高級醇;7)石油醚;8)異丙醚;9)1,4-二氧六環;10)N-甲基吡咯烷酮;11)乙酸乙酯;12)極性溶劑如N,N-二甲基甲醯胺(DMF)、二甲基亞碸(DMSO)、乙腈等;13)CH2Cl2;14)CHCl3;15)CCl4;16)THF。
具體的,以加替沙星中間體:1-環丙基-6,7,8-三氟代-1,4-二氫代-4-氧代喹啉基-3-羧酸乙酯為例,所述方法如下:
(1)攪拌下,將甲醯基乙酸乙酯鈉鹽分批加到環丙胺鹽酸鹽的甲苯溶劑中,升溫至回流分水,反應完全後冷卻,反應液於25~35℃下緩慢滴加到四氟苯甲醯氯、三乙胺和甲苯的混合溶液中,滴加完後,50℃保溫反應3~8小時,反應完全後濾除固體鹽,加水洗滌有機相,乾燥濃縮得α-取代芳醯基-β-取代氨基丙烯酸乙酯,所述環丙胺鹽酸鹽、甲醯基乙酸乙酯鈉鹽、四氟苯甲醯氯、三乙胺物質的量之比為1:1:1:1;
(2)在K2CO3存在的甲苯溶劑中,加入α-取代芳醯基-β-取代氨基丙烯酸乙酯,加熱至回流,6小時後停止反應,冷卻後減壓過濾取母液,水洗,蒸除溶劑,加異丙醇精製,真空乾燥,得白色粉末固體,即1-環丙基-6,7,8-三氟代-1,4-二氫代-4-氧代喹啉基-3-羧酸乙酯;所述α-取代芳醯基-β-取代氨基丙烯酸乙酯、K2CO3物質的量之比為1:1。
該發明所述的喹諾酮主環的合成方法的可能的原理如下:
有益效果
《喹諾酮主環化合物的合成方法》的有益效果主要體現在:
1)、反應簡單,原子利用率高;
2)、省略了以二甲胺作保護劑,降低了成本,改善了生產環境;
3)、避免了使用硫酸二甲酯、氫化鈉或金屬鈉等致癌、易燃易爆的原料。
權利要求
1.《喹諾酮主環化合物的合成方法》所述方法如下:(1)式(II)所示的銨鹽與甲醯基乙酸酯鹼金屬鹽在有機溶劑1中進行胺化反應得到β-取代氨基丙烯酸酯(III),然後再與鄰鹵芳醯氯進行偶聯反應得到式(IV)所示的α-取代芳醯基-β-取代氨基丙烯酸酯;
(2)所述α-取代芳醯基-β-取代氨基丙烯酸酯(IV)再經環合反應得到所述的喹諾酮主環化合物(I);
式(I)、(II)、(III)、(IV)中:R1和R2各自獨立為H,或C1~C4的烷基,或C3~C6的環烷基,或芳基,或與N相連的飽和或不飽和的帶不多於2個雜原子的五元環或六元環,雜原子為O、S或SO2;R3為1~4個碳原子的烷基或H;R4、R5、R6各自獨立為H,或鹵素,或硝基,或氨基,或1-取代環丙烷基,或取代或不取代的哌嗪基,或取代或不取代的吡咯基;X為無機酸或有機酸的陰離子;Y為鹵素、-SCH3、-SO2CH3或硝基;A為N或C-R7,R7為H、-CH3、-OCH3、鹵素、硝基或氰基,或與R1連線成環。
2.如權利要求1所述的喹諾酮主環化合物的合成方法,其特徵在於所述無機酸或有機酸為下列之一:HF,HCl,HBr,H2SO4,HNO3,H3PO4,H2CO3,甲酸,乙酸,丙酸,丁酸,氯乙酸,二氯乙酸, 三氯乙酸,三氟乙酸,甲磺酸,苯磺酸,甲苯磺酸。
3.如權利要求1所述的喹諾酮主環化合物的合成方法,其特徵在於所述步驟(2)為:式(IV)所示的α-取代芳醯基-β-取代氨基丙烯酸酯於有機溶劑2中、在縛酸劑存在下,於30~220℃下反應時間5~8小時,反應結束後,反應液經分離純化得到所述的喹諾酮主環化合物,所述縛酸劑為路易斯鹼,所述α-取代芳醯基-β-取代氨基丙烯酸酯與縛酸劑物質的量之比為1:0.5~3,所述的有機溶劑2的用量為化合物(IV)質量的1~8倍。
4.如權利要求1或2所述的喹諾酮主環化合物的合成方法,其特徵在於所述步驟(1)中鄰鹵芳醯氯、甲醯基乙酸酯鹼金屬鹽、銨鹽物質的量之比為1:1~1.5:1~2,所述的有機溶劑1為甲醯基乙酸酯鹼金屬鹽質量的1.2~10倍。
5.如權利要求1或2所述的喹諾酮主環化合物的合成方法,其特徵在於所述步驟(1)中胺化反應溫度為-10~120℃。
6.如權利要求1或2所述的喹諾酮主環化合物的合成方法,其特徵在於所述步驟(1)中偶聯反應溫度為5~100℃。
7.如權利要求1或3所述的喹諾酮主環化合物的合成方法,其特徵在於所述有機溶劑1、有機溶劑2各自獨立為下列之一或其中兩種或兩種以上的混合物:①烷基苯,②鹵代苯,③烷基鹵代苯,④脂環烴。
8.如權利要求1或2所述的喹諾酮主環化合物的合成方法,其特徵在於所述有機溶劑1為下列之一:CH2Cl2、CHCl3、CCl4、戊烷、己烷、庚烷、甲醇、乙醇、異丙醇、環己醇、丁二醇、乙酸乙酯、乙 酸丁酯、異丙醚、乙醚、丙酮、丁酮、N-甲基吡咯烷酮、四氫呋喃、N,N-二甲基甲醯胺、二甲基亞碸、乙腈。
9.如權利要求3所述的喹諾酮主環化合物的合成方法,其特徵在於所述有機溶劑2為下列之一:高級醇、石油醚、異丙醚、1,4-二氧六環、N-甲基吡咯烷酮、乙酸乙酯、N,N-二甲基甲醯胺、二甲基亞碸、乙腈、CH2Cl2、CHCl3、CCl4、四氫呋喃。
10.如權利要求1所述的喹諾酮主環化合物的合成方法,其特徵在於所述喹諾酮主環化合物為加替沙星中間體:1-環丙基-6,7,8-三氟代-1,4-二氫代-4-氧代喹啉基-3-羧酸乙酯,所述方法如下:
(1)攪拌下,將甲醯基乙酸乙酯鈉鹽分批加到環丙胺鹽酸鹽的甲苯溶劑中,升溫至回流分水,反應完全後冷卻,反應液於25~35℃下緩慢滴加到四氟苯甲醯氯、三乙胺和甲苯的混合溶液中,滴加完後,50℃保溫反應3~8小時,反應完全後濾除固體鹽,加水洗滌有機相,乾燥濃縮得α-取代芳醯基-β-取代氨基丙烯酸乙酯,所述環丙胺鹽酸鹽、甲醯基乙酸乙酯鈉鹽、四氟苯甲醯氯、三乙胺物質的量之比為1:1:1:1;
(2)在K2CO3存在的甲苯溶劑中,加入α-取代芳醯基-β-取代氨基丙烯酸乙酯,加熱至回流,6小時後停止反應,冷卻後減壓過濾取母液,水洗,蒸除溶劑,加異丙醇精製,真空乾燥,得白色粉末固體,即1-環丙基-6,7,8-三氟代-1,4-二氫代-4-氧代喹啉基-3-羧酸乙酯;所述α-取代芳醯基-β-取代氨基丙烯酸乙酯、K2CO3物質的量之比為1:1。
實施方式
實施例1
攪拌下,將5.61克(0.06摩爾)環丙胺鹽酸鹽(II-1)加到60毫升甲苯中,升溫至回流,分批加入8.28克(0.06摩爾)甲醯基乙酸乙酯鈉鹽,回流分水反應約3小時至無水分出,冷卻,反應液於25~35℃下緩慢滴加到由12.75克(0.06摩爾)2,3,4,5-四氟苯甲醯氯、6.06克(0.06摩爾)三乙胺和40毫升甲苯組成的混合溶液中,滴加完後50℃保溫攪拌反應約3小時,TLC跟蹤反 應完全,過濾除固體鹽,再加水(50毫升×2)洗滌有機相,硫酸鎂乾燥,濃縮製得化合物(IV-1)18.8克,收率94.6%。
實施例2
將溶劑甲苯改為異丙醚,其他條件同實施例1,製得化合物(IV-1)18.6克,收率93.6%。
實施例3
將33.1克(0.1摩爾)化合物(IV-1)、13.8克(0.1摩爾)K2CO3加入到100毫升甲苯溶劑中加熱至回流,6小時後停止反應,冷卻後減壓過濾取濾液,水洗(80毫升×2),蒸除溶劑,加異丙醇精製,真空乾燥,得28.0克白色粉末固體產物(I-1),即1-環丙基-6,7,8-三氟代-1,4-二氫代-4-氧代喹啉基-3-羧酸乙酯,收率90.0%。
實施例4
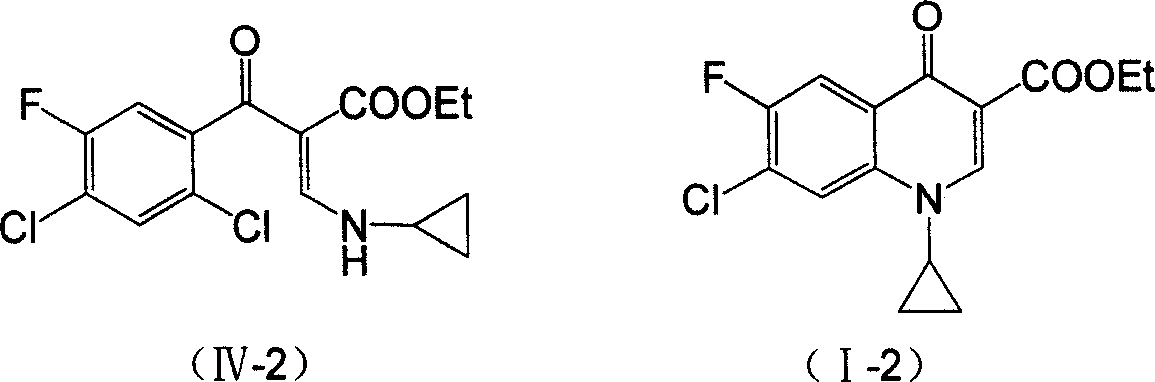
攪拌下,將5.61克(0.06摩爾)環丙胺鹽酸鹽(II-1)加到60毫升二氯苯(異構體混合物)中,升溫至回流,分批加入8.28克(0.06摩爾)甲醯基乙酸乙酯鈉鹽,回流分水反應約3小時至無水分出,冷卻,反應液於25~35℃下緩慢滴加到由13.65克(0.06摩爾)2,4-二氯代-5-氟代苯甲醯氯、6.06克(0.06摩爾)三乙胺和40毫升二氯苯組成的混合溶液中,滴加完後50℃保 溫攪拌反應約3小時,TLC跟蹤反應完全,過濾除固體鹽,再加水(50毫升×2)洗滌有機相,硫酸鎂乾燥,蒸除溶劑製得化合物(IV-2)18.7克,收率90.1%。
實施例5
將17.3克(0.05摩爾)化合物(IV-2)、4.14克(0.03摩爾)K2CO3加入到80毫升甲苯溶劑中加熱至回流,6小時後停止反應,冷卻後減壓過濾取母液,蒸除溶劑,加乙醇重結晶,真空乾燥,得13.7克白色粉末固體產物(I-2),即1-環丙基-6-氟代-7-氯代-1,4-二氫代-4-氧代喹啉基-3-羧酸乙酯,收率88.5%。
實施例6
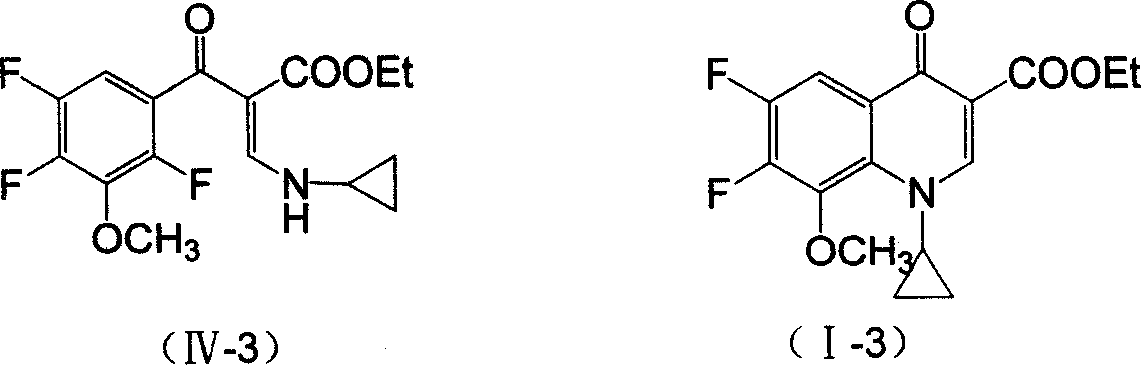
攪拌下,將93.5克(1摩爾)環丙胺鹽酸鹽(II-1)加到250毫升甲苯中,升溫至回流,分批加入138克(1摩爾)甲醯基乙酸乙酯鈉鹽,回流分水反應約3小時至無水分出,冷卻,反應液於25~35℃下緩慢滴加到由224.5克(1摩爾)2,4,5-三氟代-3-甲氧基苯甲醯氯、101克(1摩爾)三乙胺和150毫升甲苯組成的混合溶液中,滴加完後50℃保溫攪拌反應約3小時,TLC跟蹤反應完全,過濾除固體鹽,再加水(200毫升×2)洗滌有機相,硫酸鎂乾燥,蒸除溶劑製得化合物(IV-3)327克,收率95.3%。
實施例7
將34.3克(0.1摩爾)化合物(IV-3)、8.28克(0.06摩爾)K2CO3加入到100毫升甲苯溶劑中加熱回流至分水,8小時後停止反應,冷卻後減壓過濾取母液,水洗(80毫升×2),蒸除溶劑,加異丙醇精製,真空乾燥,得29.14克白色粉末固體產物(I-3),即1-環丙基-6,7-二氟代-8-甲氧基-1,4-二氫代-4-氧代喹啉基-3-羧酸乙酯,收率90.2%。
榮譽表彰