表面預處理
已提出不同類型的數學式,各有其適用範圍,常用的有以下兩種:①弗蘭德里希(Freundlich)吸附等溫式,在中等濃度時,其
經驗公式可表述為 (n>1)若取
對數,則 為一
直線方程式。式中:C是作用達到平衡時溶液的濃度;K、n是在一定範圍內表示吸附過程的經驗
係數。②朗繆爾(Langmuir)吸附等溫式,其基本形式可表達為式中:Q為任一
平衡狀態時的吸附量;Qo為單位表面上達到飽和時最大極限吸附量;b=Ka/ Kb為吸附與解吸的比例關係的比值。該方程能較好地適合各種濃度,並且式中每一項都有較明確的
物理意義。吸附等溫式是
定量研究環境中膠體對各種
元素遷移的影響的重要方法。③BET吸附等溫式,其基本表達式為
,式中V
m為鋪滿單分子層所需氣體的體積;C為與吸附熱有關的常數;p,V為吸附時的壓力和體積;p
s為試驗溫度下吸附質的飽和蒸汽壓。此公式在朗繆爾單分子層吸附理論的基礎上,提出的多分子層吸附理論。
 12-12
12-12其他信息
此
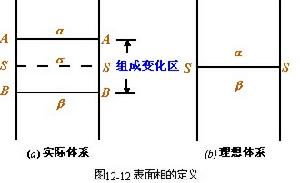
表面層也可理解為是兩體相的過渡區域。從另一角度定義了表面相,將表面相理想化為一無厚度的幾何平面SS,即將表面層與本體相的差別,都歸結於發生在此平面內。根據這個假設,
吉布斯套用熱力學方法導出了等溫條件下溶液
表面張力隨組成變化關係,稱為"吸附等溫式"。
吸附等溫式在重金屬吸附性能研究中的套用
氨基澱粉(CAS)、二硫代氨基改性澱粉(DTCS)、殼聚糖(CTS)、二硫代氨基改性殼聚糖(DTC-CTS)4種吸附劑對銅 、鉛 、鋅3種重金屬離子的吸附性能,套用吸附等溫式考察4種吸附劑對重金屬的吸附選擇性。結果表明,對於4種吸附劑 ,Langmuir-Freundlich等溫式的計算結果與試驗結果可以較好地吻合,與單因素Langmuir 等溫式的計算結果聯合,可以預計多組分體系的吸附選擇性,從而在實際工藝中可以節省試驗步驟。
pH 適應性
TETAS,DTCS,C TS,DTC-CTS在吸附水溶液中重金屬時,都表現出一定的pH適應範圍。在溶液初始銅濃度為0.5mmol。L-1時,以溶液pH值為橫坐標,分配比D的對數為縱坐標(D=Qe/Ce,Qe和Ce分別為吸附平衡時的吸附量和重金屬離子濃度)。
改性澱粉吸附銅的效果比相應的改性殼聚糖的效果好,吸附量大。這是因為改性澱粉的每個結構單元所連線的氨基更多,殼聚糖每個結構單元最多只連線一個氨基,且殼聚糖在水中的溶脹性低於改性澱粉。與帶有氨基的吸附劑相比,帶有DTC基團的DTCS和DTC-CTS表現出更好的pH穩定性。帶有氨基的TETAS與CTS比,具有更好的pH穩定性,這可能是因為前者具有緊密的交聯結構。
吸附劑的吸附選擇性
1、單組分體系吸附容量比較。已有的實驗結果表明,所研究的4種吸附劑對重金屬的吸附均符合Langmuir等溫式。
可以看出,4 種吸附劑對重金屬具有吸附選擇性。(1)帶有DTC基團的DTCS和DTC-CTS對三種金屬的選擇性低,由langmuir吸附等溫式計算得到的飽和吸附量Qm的差別較小,按照Cu >Pb >Zn的順序遞減。(2)CTS對三種金屬的Qm按照Cu>Pb>Zn的順序遞減 ,而TETAS則按照Cu>Zn>Pb的順序遞減,這可能是由於TETAS中的基團主要是氨基,羥基較少,但是在CTS中羥基較多,氨基N和羥基O共同螯合金屬離子,增加了與鉛的結合力,所以對鉛的吸附量增加。(3)對於含有相同功能基的吸附劑,改性澱粉吸附重金屬性能優於改性殼聚糖。
2、雙組分溶液中重金屬離子的吸選擇性。進行雙組分體系吸附選擇性實驗的條件為:25℃,溶液體積25mL,銅 、鉛 、鋅的初始濃度皆為0.5mmol。L -1,吸附劑的投加量均為10mg。
對於雙組分體系,藉助擴展的 Langmuir 等溫式和三參數的Langmuir-Freundlich方 程式比較4種吸附劑的吸附選擇性。顯示了兩種模型計算結果和試驗值的對比關係。吸附劑標號1~4分別代表TETAS,DTCS,CTS 和DTC-CTS,L和L-F分別代表根據擴展的Langmuir等溫式和三參數的Langmuir-Freundlich方程式所得的計算結果。
對比兩種預計競爭吸附的模型,可以看出,三參數的Langmuir-Freundlich方程式與試驗結果更相近,可以用來預測結果 、指導套用。在實際廢水體系中,可以依據已有的單組分數據以及Langm uir-Fre-undlich方程式估算在 雙組分或多組分體系中吸附劑的選擇性,從而選擇合適的吸附劑,這對實際工藝而言,可以節省試驗操作。
3、改性澱粉吸附重金屬性能優於改性殼聚糖的原因分析。由試驗結果可以看出,對於含有相同功能基的吸附劑,改性澱粉吸附重金屬性能優於改性殼聚糖。
首先,將TETAS與CTS進行比較。與CTS相比,TETAS中氨基數目更多,能鍵合更多的金屬離子,且TETAS的高分子骨架為交聯結構,所以表現出更優良的抗酸和絮體沉降性能。此外,在TETAS中相鄰氨基間隔兩個碳原子,空間結構適於與重屬的螯合。
纖維素酶對纖維素纖維吸附等溫式
在非均相固~液平衡吸附反應的基礎上,推導了纖維素酶對纖維素纖維的吸附等溫方程式,結果表明纖維平 衡吸附酶量與吸附時溶液中的纖維濃度和酶濃度都是呈雙曲線關係,並且,該吸附等溫方程與實驗結果具有良好的一致性。
酶解過程模型
由於纖維素酶對纖維素纖維的催化水解為一 多相催化反應體系,纖維素纖維的主要成份不溶於水,且纖維素大分子在纖維內排列形成緊密的複合結構,酶必經擴散到纖維表面或內部,才能與纖維素分子發生接觸而產生吸附作用,進而開始水解。因此,纖維素酶與纖維的水解反應,應包括以下幾個過程:(1)酶從本體液相轉移到纖維素纖維固體表面;(2) 酶被纖維素吸附並形成ES複合物;(3) 酶水解纖維素分子;(4) 纖維糊精、纖維二糖等水溶性水解產物從纖維固體表面轉移到液相;(5) 溶液中的纖維糊精、纖維二糖等水解成葡萄糖。在以上過程 ,ES複合物的形成在酶解過程中是關鍵 一步,對纖維素酶處理織物的程度和性能有很大的影響。
吸附等溫方程式的數學推導
若假定式酶對纖維的吸附過程要快於產物形成過程,即kl》kZ,在纖維素酶與纖維素反應體系中,當纖維素酶與纖維吸附達到平衡時,存在下式:K=〔e〕〔s 〕/ 〔es 〕
式中,K為吸附平衡常數 ( mol/L );〔e〕為吸附平衡時液相中游離的酶濃度 (mol/L);〔es 〕為酶與纖維吸附形成複合物的濃度 ( mlo/L );〔s 〕為未吸附酶的纖維素底物的濃度 (mlo/L ),其中lmol 重量的纖維素底物能夠吸附lmol的酶蛋白。
在棉纖維濃度較高的條件下 ( 〔s0 〕=60g/L ),酶對纖維的吸附過程很快,在極短時間內,纖維結合酶蛋白量已接近最大值;當吸附時間達30mni時,纖維吸附酶的速率已趨於零,表明纖維吸附酶已經達到平衡。而在〔s0〕 較低的情況下 (〔s0〕= 10g/L ),纖維吸附酶的速率相對較低,隨處理時間增長,吸附酶量逐漸增加,但處理30min之後也趨於平衡。
不同濃度的SF纖維素酶在棉、粘膠和亞麻纖維的濃度〔s0〕=40g/L、pH4.8、溫度50℃的條件下,分別處理30mni,測得的纖維吸附的酶蛋白量 〔ES 〕和溶液中游離酶蛋白量 〔p〕的關係可見,棉、粘膠和亞麻纖維在不同濃度SF纖維素酶處理時,吸附達到平衡後的〔s0{P一P0 (1 一 a) } /〔ES 〕與{P一P0(1 一 a) }存在良好的直線關係,其結果與雙倒數形式顯著線性相關,且在0.01 水平下其相關係數均大於0. 978, 這也從另 一方面證明了吸附方程式是合理的。
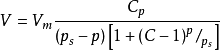
 12-12
12-12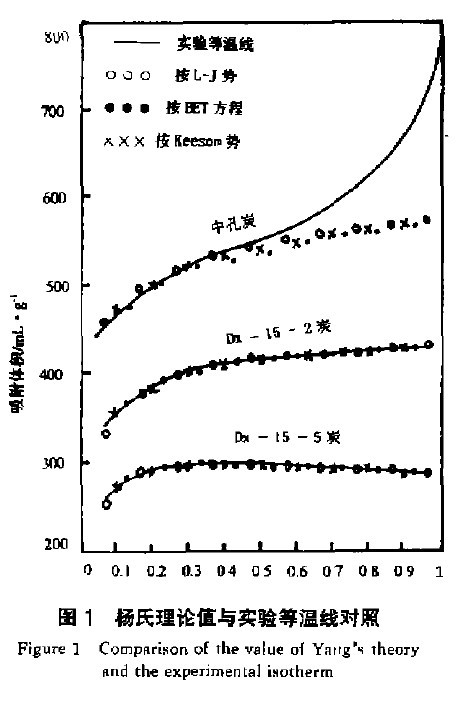
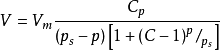
 12-12
12-12