根據合成氨工業原理,在酸性環境下利用氮氣與氫氣的氧化還原反應製作而成的原電池稱為合成氨原電池。工業上用氮氣和氫氣在高溫高壓和催化劑的催化下直接合成氨氣,氫在此反應過程中失去電子,而氮得到電子,符合原電池原理。即氫氣做原電池的負極,氮氣做原電池的正極。
基本介紹
- 中文名:合成氨原電池
- 外文名:The original ammonia cell
- 套用學科:化學、物理學
- 原理:原電池原理、氧化還原原理
原電池的概念,合成氨工業,工作原理,研製現狀,
原電池的概念
一般原電池的工作原理屬於放熱的氧化還原反應,但電子轉移不是通過氧化劑和還原劑之間的有效碰撞完成的,而是還原劑在負極上失電子發生氧化反應。電子通過外電路輸送到正極上,氧化劑在正極上得電子發生還原反應,從而完成還原劑和氧化劑之間電子的轉移。兩極之間溶液中離子的定向移動和外部導線中電子的定向移動構成了閉合迴路,使兩個電極反應不斷進行,發生有序的電子轉移過程,產生電流,實現化學能向電能的轉化。

合成氨工業
合成氨反應式:N2(g)+3H2(g)≒2NH3(g)
合成氨的適宜條件:
壓強:20~50MPa
溫度:500℃左右
壓強:20~50MPa
溫度:500℃左右
(在實驗室里一般是在較低的溫度和壓強下進行的,只能了解氮氣和氫氣在催化劑作用下能生成氨氣。)
在此化學反應式中,氫失去電子、氮得到電子,這是一個氧化還原反應,符合原電池原理。所以只要將合成氨工業的工序加以改造,理論上可以實現原電池的製造。
工作原理
如普通的原電池一樣,合成氨原電池的負極發生氧化反應。所以在此裝置中,氫氣為負極,氮氣為正極。氫負極上失電子,電子通過外電路輸送到正極上,氮在正極上得電子發生還原反應,從而完成還原劑和氧化劑之間電子的轉移,從而實現化學能向電能的轉化。
研製現狀
圖示合成氨:
製作合成氨原電池需要改進合成氨工業的工序,所以還沒有真正意義上的工業合成氨原電池產品被製造並投入使用。但合成氨原電池符合原電池原理,是能夠被製作出來的。將合成氨工業與合成氨原電池結合起來,對物料的利用率、工作效率將會大大提高。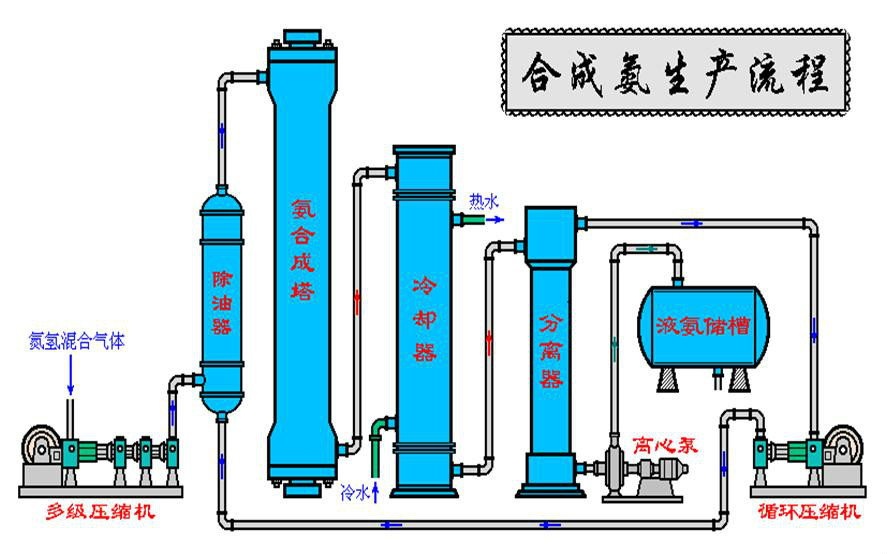

改進合成氨工業是一個比較複雜的技術難題,所以利用合成氨工業製作合成氨原電池是有一定的難度,需要更多的人去研究和克服困難。

