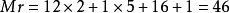概念背景
既然
元素的相對原子質量是一個單位為“1”的相對質量,那么由此計算得到的分子質量必然也是一個單位為“1”的相對質量。對於某些結構複雜的生物大分子,往往都是通過電泳、離心或色譜分析等方法測得其近似分子質量,因而更是一個相對概念的量值。所以,我們過去長期習慣使用著的“分子量”實際上都是相對的分子質量。因此,國標指出“以前稱為分子量”的即是“相對分子質量”(relativemolecularmass),並將後者定義為“物質的分子或特定單元的平均質量與核素
12C原子
質量的1/12之比”。
相對分子質量是兩個質量之比,也在 計算表達形式上進一步明確了“相對”的含義。對於定義中的“特定單元”,主要是指
空氣等組成成分基本不變的特殊混合物,它們的相對質量可根據其組成成分(N
2,O
2,CO
2,Ar等)的相對分子質量和其在空氣中的體積分數計算其平均質量,然後與
12C原子質量的1/12相比即可獲得。相對分子質量的量符號為M
r.,單位為“1”。
計算方法
以二氧化碳為例來說明相對分子質量的計算方法:
二氧化碳的製備、淨化、乾燥與收集
按圖所示裝配好二氧化碳氣體發生與淨化裝置,大理石與鹽酸在啟普發生器中反應生成的CO2氣體,通過洗氣瓶2的水、洗氣瓶3的濃H2SO4的洗滌和乾燥管4的無水CaCl2乾燥或者經過1mol L-1CuSO4溶液、1mol L-1NaHCO3溶液洗滌和無水CaCl2乾燥後,導人錐形瓶5的氣體即為純淨的CO2氣體 。
 二氧化碳的製備、淨化、乾燥與收集裝置示意圖
二氧化碳的製備、淨化、乾燥與收集裝置示意圖稱重
1.m1:瓶+塞子+空氣的質量
取一潔淨而乾燥的錐形瓶,選一個合適的橡皮塞塞緊瓶口,在塞子上做一個記號,標出塞子塞人瓶內的位置,在電子天平上稱量質量,記為m1。
2.m2:CO2+瓶+塞子的質量
從啟普發生器中產生的二氧化碳氣體,需經過洗氣、乾燥、收集、稱量。因為二氧化碳的密度大於空氣,所以必須將導管插入瓶底,才能將瓶內的空氣趕盡,氣體收滿後;緩慢取出導管,用塞子塞緊瓶口(塞子塞人瓶口的位置應與步驟1中一樣),在電子天平上稱質量,記為m2。重複操作3次,直至前後3次的質量相差不超過1mg為止。
3.m3:水+瓶+塞子的質量
最後在瓶內裝滿水,塞緊塞子,在台秤上稱質量,記為m3。
4.記下室溫和大氣壓
數據處理
數據處理按照下圖進行數據填補與計算
 二氧化碳相對分子質量的測定數據記錄與結果處理
二氧化碳相對分子質量的測定數據記錄與結果處理計算格式
Mr=Ar+Arasz
注意事項
相對分子質量在數值上等於
摩爾質量,但單位不同。相對分子質量的單位是“1” ,而摩爾質量的單位是g/mol;而相對分子質量最小的氧化物的
化學式為H
2O。
常見相對原子質量
| 元素名稱 | 元素符號 | 相對原子質量 |
|---|
氫 | H | 1 |
碳 | C | 12 |
氮 | N | 14 |
氧 | O | 16 |
鈉 | Na | 23 |
鎂 | Mg | 24 |
鋁 | Al | 27 |
矽 | Si | 28 |
磷 | P | 31 |
硫 | S | 32 |
氯 | Cl | 35.5 |
鉀 | K | 39 |
鈣 | Ca | 40 |
錳 | Mn | 55 |
鐵 | Fe | 56 |
銅 | Cu | 64 |
鋅 | Zn | 65 |
銀 | Ag | 108 |
碘 | I | 127 |
鋇 | Ba | 137 |
金 | Au | 197 |
 二氧化碳的製備、淨化、乾燥與收集裝置示意圖
二氧化碳的製備、淨化、乾燥與收集裝置示意圖 二氧化碳相對分子質量的測定數據記錄與結果處理
二氧化碳相對分子質量的測定數據記錄與結果處理