簡介
它是給飽和溶液結晶的一種方法。實質上就是通過降低溫度的方法使溶質從溶液中以晶體的形式析出來(適用於溶解度隨溫度的升高而明顯增大的物質)。一般就是指把在溫度比較高的情況下飽和的溶液將其溫度降低,使其析出晶體的過程.。
原理
溫度影響物質的溶解度,一般是溫度上升,溶解度就跟著上升(也有溫度上升,溶解度跟著下降的,例如
氫氧化鈣、二氧化碳等物質)。然後在高溫下把溶液弄成飽和狀態。這個時候單位溶液里的溶解物含量很高,然後降溫,使溶解度降低,這樣單位溶液里的溶解物含量應該降低,而這多餘的溶解物只好以固體(晶體)的形式從溶液中析出來。這就是冷卻熱飽和溶液結晶法。簡稱冷卻熱飽和溶液法。可溶物質在不同的溫度時,溶解度也不同。大部分物質是隨溫度的升高,溶解度也隨之升高的。冷卻熱飽和溶液法也只適用於這樣的物質。
方法是:在較高溫度時,使溶液達到飽和狀態,這樣在溫度降低後,因為物質的溶解度下降,溶液中會析出這種物質的晶體。
冷卻熱飽和溶液法是用來結晶
溶質隨溫度的變化其溶解度變化較明顯的物質(
蒸發溶劑結晶法是用來結晶溶質隨溫度的變化其溶解度變化不明顯或基本無變化的物質)。
當溶液被冷卻時,這時溶液的溫度是逐漸下降的,這個時候只有“溶解度隨溫度變化較大的物質”它的溶解度越來越小,這個時候它就結晶析出了,當然這種情況也是發生在溶解度隨溫度的升高而增大的物質上。反之,則是給溶解度隨溫度的升高而減小的物質結晶的方法。
工業上,此法常與
濃縮聯合使用,先濃縮溶液,然後使用冷卻熱飽和溶液結晶法,得到該溶質結晶,然後離心,得到此種溶質。
注意事項
1:冷卻熱飽和溶液結晶法(簡稱冷卻結晶法)與蒸髮結晶法的區別:
冷卻結晶:先加熱後冷卻,適用於溶解度隨溫度升高而增大隨溫度減小而降低的物質。如KNO3.蒸髮結晶:就是一直加熱,知道析出晶體,使用於溶解度隨溫度變化不大的物質。如NaCl 。
2:此法適用於的溶質,必須滿足“溶質的
溶解度與溫度成正比。即溶質的溶解度隨溫度的升高而升高”。
在溫度較高的情況下,且溶液已經達到飽 和,此時冷卻溶液,溶液的溫度降低,溶質的溶解 度下降,溶質就會長出晶體,結晶析出。
工業上,此法常與濃縮聯合使用,先濃縮溶 液,然後使用
冷卻熱飽和溶液結晶法,得到該溶質 結晶,然後離心,得到此種溶質。
它在工業上的套用非常廣泛,但是工業上在 套用是還必須考慮一個重要條件,就是,溶質的溶 解度必須對溫度非常敏感。即在溫度下降時,溶質 的溶解度必須要有一個比較大的改變,這樣才可以 得到大量的結晶,產生效益。否則不能適用。
舉例:粗鹽的提純
第一步稱量:用托盤天平稱量一定質量的粗鹽
第二步溶將稱量好的粗鹽放入乾燥的燒杯中,加水溶解,加一點溶一點,並用玻璃棒攪拌
第三步過濾:將濾紙折成四折,撐開,放在漏斗中,一邊三折,一邊一折,濾紙邊緣一定要低於漏斗邊緣,將玻璃棒抵在三層的濾紙邊緣,將燒杯嘴靠在玻璃棒上,慢慢倒液體,記住液體高度不要超過濾紙邊緣(注意:漏斗口靠在燒杯壁上)
第四步蒸發:將濾液倒入蒸發皿中,點燃酒精燈,等到液體略微沸騰時,邊加熱邊用玻璃棒攪拌,防止液體飛濺,等到蒸發皿中有較多固體析出時,停止加熱。
其他提純方法
重結晶
重結晶是將晶體溶於溶劑或熔融以後,又重新從溶液或熔體中結晶的過程。重結晶可以使不純淨的物質獲得純化,或使混合在一起的鹽類彼此分離。
重結晶獲得的分離出來溶解度大的溶液可能是雜質,也可能使需要的溶質。套用面廣泛。冷卻熱飽和法只能利用低溫溶解度低的性質得到所需溶質。
萃取
萃取----利用物質在兩種互不相容的溶劑中的
溶解度不同,將物質從一種溶劑里提取到另一種溶劑里使溶質和溶劑分離的分離方法。
 萃取裝置圖
萃取裝置圖蒸餾
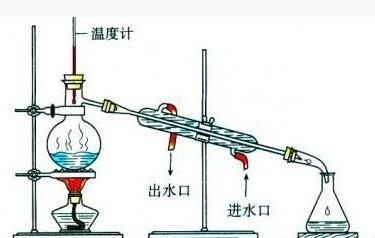
蒸餾是一種熱力學的分離工藝,它利用混合液體或液-固體系中各組分
沸點不同,使低沸點組分蒸發,再冷凝以分離整個組分的單元操作
過程,是蒸發和冷凝兩種單元操作的聯合。與其它的分離手段,如萃取、過濾結晶等相比,它的優點在於不需使用系統組分以外的其它
溶劑,從而保證不會引入新的
雜質。
套用
它在工業上的套用非常廣泛,但是在工業上套用還必須考慮一個重要條件,就是,溶質的溶解度必須對溫度非常敏感。即在溫度下降時,溶質的溶解度必須要有一個比較大的改變,這樣才可以得到大量的結晶,產生效益。否則不能適用。在實驗室里為獲得較大的完整晶體,常使用緩慢降低溫度,減慢
結晶速率的方法。
 萃取裝置圖
萃取裝置圖

