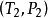克克方程全稱克勞修斯-克拉佩龍方程,是用於描述單組份系統在相平衡時壓強隨溫度的變化率的方法,以魯道夫·克勞修斯和埃米爾·克拉佩龍命名。
基本介紹
- 中文名:克克方程
- 外文名:Clausius-clapeyron equation
- 全稱:克勞修斯-克拉佩龍方程
- 命名者1:魯道夫·克勞修斯
- 命名者2:埃米爾·克拉佩龍
公式,相變焓,
公式
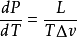
此處dP/dT 是壓強隨溫度的變化率, L是相變焓(早年稱為潛熱),T 是相平衡溫度,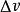 是相變過程中的比容變化。
是相變過程中的比容變化。
在化學中一般討論理想氣體狀態下的克克方程,也是從理想狀態氣體開始推導。
對於有氣相參加的相變過程,氣相比容體積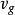 要遠遠大於固體或液體的體積
要遠遠大於固體或液體的體積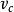 ,所以固體和液體的體積可以忽略
,所以固體和液體的體積可以忽略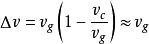 在較低的壓力和氣體分子間作用力的前提下,氣體可以近似視為理想氣體
在較低的壓力和氣體分子間作用力的前提下,氣體可以近似視為理想氣體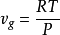 ,此處R是氣體常數。於是
,此處R是氣體常數。於是
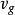
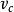
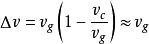
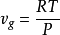

這就被稱為克勞修斯-克拉佩龍方程。
相變焓
一般來說,相變焓是溫度的函式,但如果相變焓隨溫度變化不大, 那么可以積分得
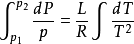
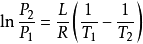
這裡 和
和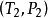 是P-T圖上的兩個點,這是很有用的一個關係,因為他聯繫了飽和蒸汽壓、溫度和相變焓。不需要比容的數據,就可以估算飽和蒸汽壓隨溫度變化的關係。
是P-T圖上的兩個點,這是很有用的一個關係,因為他聯繫了飽和蒸汽壓、溫度和相變焓。不需要比容的數據,就可以估算飽和蒸汽壓隨溫度變化的關係。