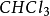基本介紹
- 中文名:價態
- 外文名:valence state
- 別名:化合價
- 適用範圍:化學
簡述,正價,負價,特殊情況,
簡述
價有正負之分;給出電子的為正價,獲得電子的為負價。通常以氫的化合價等於1作為標準。例如,水分子( )中氧原子為負2價(
)中氧原子為負2價( ),氫原子為正1價(
),氫原子為正1價(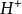 )。一般硫酸根(
)。一般硫酸根(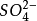 )為負2價,氫氧根(
)為負2價,氫氧根(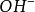 )為負1價。同一元素的不同價態在環境中的化學行為與生物效應有很大的不同。如重金屬在微生物酶的氧化還原反應中,可形成幾種不同的價態混合存在於環境或生物體中;如鈷同時有+1、+2和+3價,鉻有+2、+3和+6價,砷有+3和+5價等。不同價態的毒性差別很大;如+6價鉻毒性最強,+3價鉻次之,+2價鉻和元素鉻(單質)幾乎無毒性;+3價砷的毒性很強,比5價砷高
)為負1價。同一元素的不同價態在環境中的化學行為與生物效應有很大的不同。如重金屬在微生物酶的氧化還原反應中,可形成幾種不同的價態混合存在於環境或生物體中;如鈷同時有+1、+2和+3價,鉻有+2、+3和+6價,砷有+3和+5價等。不同價態的毒性差別很大;如+6價鉻毒性最強,+3價鉻次之,+2價鉻和元素鉻(單質)幾乎無毒性;+3價砷的毒性很強,比5價砷高 倍,這是由於不同價態物質的溶解度、與巰基(
倍,這是由於不同價態物質的溶解度、與巰基(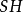 )的親和力等物理化學性質有較大的不同所致。
)的親和力等物理化學性質有較大的不同所致。


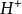
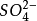
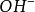

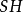
一般來說,元素的化合價分為三種情況:
1、最高化合價:失去最外電子層的所有電子,使自身達到相對穩定狀態。(例如高氯酸: ,它的氯元素失去了最外電子層的所有7個電子,達到最高價態+7價。)
,它的氯元素失去了最外電子層的所有7個電子,達到最高價態+7價。)

2、中間價態:得到或失去一定數目的電子,同樣可以使自身達到相對穩定狀態。(例如一氧化碳: ,它的碳元素沒有達到最高的+4價,也沒有達到最低的-4價,而是處於一種中間價態。)
,它的碳元素沒有達到最高的+4價,也沒有達到最低的-4價,而是處於一種中間價態。)

3、最低化合價:得到一定數目的電子,使最外電子層的電子數達到飽和,使自身達到相對穩定狀態。(例如甲烷: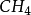 ,它的碳元素得到了4個電子達到了最低價態-4價。)
,它的碳元素得到了4個電子達到了最低價態-4價。)
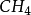
正價
正價一般是金屬元素在化合物中顯現的價態(例: 中的
中的 就顯現出正3價)。也有些非金屬元素的價態會顯現出正價,一般是氫、碳、矽這些最外層電子數為滿電荷數一半的元素。既可以失電子,也可以得電子。所以也可以顯現出正價(例:
就顯現出正3價)。也有些非金屬元素的價態會顯現出正價,一般是氫、碳、矽這些最外層電子數為滿電荷數一半的元素。既可以失電子,也可以得電子。所以也可以顯現出正價(例: 中的
中的 就顯現出+4價)。
就顯現出+4價)。




負價
負價一般是非金屬元素在化合物中顯現的價態(例: 中的
中的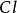 就顯現出負1價)。所有非金屬元素中,只有氟元素(
就顯現出負1價)。所有非金屬元素中,只有氟元素(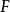 )是永遠顯負價的(因為氟元素是所有非金屬元素中,電負性最強的)。簡單來說,氟元素只有兩層電子層,最外層電子數又是7,本身就傾向於得到電子,而兩個電子層又使得原子核對電子的吸引力極大,極易獲得電子,所以氟元素只有負價。
)是永遠顯負價的(因為氟元素是所有非金屬元素中,電負性最強的)。簡單來說,氟元素只有兩層電子層,最外層電子數又是7,本身就傾向於得到電子,而兩個電子層又使得原子核對電子的吸引力極大,極易獲得電子,所以氟元素只有負價。

特殊情況
除了氫、碳、矽這些最外層電子數為滿電荷數一半的非金屬元素有正價外,一些非金屬元素在某些化合物中也有正價。
1、與氧元素化合是最常見的。氧元素絕大多數情況都是顯-2價的,非金屬元素與其化合,就會顯現出正價。(例: 、
、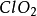 、
、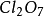 )
)

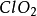
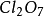
2、鹵代烴中的非金屬元素。例如氯仿(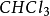 )中的氯元素就顯+1價。
)中的氯元素就顯+1價。