基本介紹
- 中文名:偏摩爾熱力學函式
- 外文名:partial molar thermodynamic function
- 定義:X隨某一組分的物質的量的偏導數
- 別名:偏摩爾量
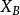


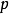
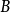
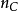
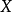
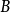
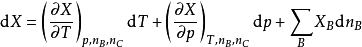
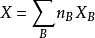
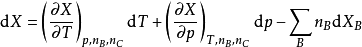
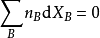
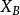


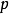
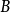
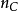
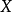
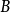
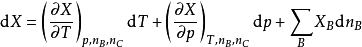
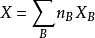
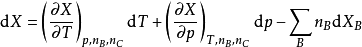
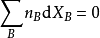
偏摩爾熱力學函式為恆溫恆壓且其他組分物質的量不變的情況下系統中的某一廣延量(如體積、焓、熵等)對某一組分物質的量的偏導數。偏摩爾熱力學函式在熱力學、...
多組分體系的所有熱力學關係均可寫成以偏摩爾量表示的對應關係,即將單組分系統的摩爾量換成多組分系統的偏摩爾量即可,熱力學函式關係並不發生變化。引入偏摩爾量...
是研究多元系容量性質時重要的熱力學量,只有在同一個相內才有偏摩爾量的概念,且只有容量性質的狀態函式在T,p一定的條件下,對某組分 的偏微分才是偏摩爾量。 ...
2.2 熱力學第二定律及熵函式的引出 2.3 熵變的計算 2.4 熱力學溫標 ...2.10 偏摩爾量和化學勢 2.11 不可逆過程熱力學簡介 本章基本要求 習題...
5.1.2 SPAC中水分相對偏摩爾熵及焓的特徵5.2 水分條件及作物生育期等對SPAC水分熱力學函式的影響5.2.1 土壤水分含量對SPAC水分熱力學函式的影響...
3.10熱力學函式間的重要關係式57 3.11單組分系統兩相平衡—克克(Clausius Clapayron)方程61 3.12多組分單相系統的熱力學——偏摩爾量63 3.13化學勢65 3.14熱...
第六節 吉布斯函式和亥姆霍茲函式一、吉布斯函式二、吉布斯函式變化的計算三、亥姆霍茲函式四、熱力學函式問的基本關係式第七節 偏摩爾量、化學勢...
一、熱力學基本方程二、對應係數關係式三、麥克斯韋關係式及套用四、吉布斯―亥姆霍茲方程五、吉布斯函式和壓力的關係六、特性函式2―9偏摩爾量一、偏摩爾量的定義...
3.6亥母霍茲函式 3.7吉布斯函式 3.8熱力學函式基本關係式 3.9純物質的兩相平衡 思考題 習題 自測題 第四章 多組分系統熱力學 4.1多組分系統 4.2偏摩爾量 4.3...
2.8熱力學函式的一些重要關係式 2.9G的求算 思考題 習題 第3章多組分系統熱力學及其在溶液中的套用 3.1偏摩爾量 3.2化學勢 3.3氣體物質的化學勢 3.4稀溶...
《矽酸鹽物理化學》內容包括熱力學在無機材料科學中的套用、無機材料聚集狀態和...1.15 熱力學函式間的關係1.16 偏摩爾量和化學勢1.17 矽酸鹽熱力學計算...
第十一節 熱力學函式之間的關係第十二節 非平衡態熱力學簡介第十三節 偏摩爾量和化學勢第十四節 化學勢的標準態及其表達式第四章 化學平衡第一節 概述...
§2.8 熱力學函式的一些重要關係式§2.9 厶C的計算§2.10 非平衡態熱力學簡介思考題第三章 化學勢§3.1 偏摩爾量§3.2 化學勢...
第七節 熱力學第三定律第八節 亥姆霍茲自由能和吉布斯自由能第九節 熱力學函式關係式第十節 偏摩爾量與化學勢第十一節 矽酸鹽熱力學計算...
§2.8 熱力學函式的?些重要關係式§2.9 厶C的計算*§2.10 非平衡態熱力學簡介思考題第三章 化學勢§3.1 偏摩爾量§3.2 化學勢...
