基本介紹
- 中文名:亞硝化反應
- 外文名:nitrosation
- 實質:取代反應
- 所屬:化學
簡介,反應機理,芳仲胺的亞硝化,芳叔胺的亞硝化,
簡介
亞硝化反應有機化合物分子中的氫被亞硝基(-NO)取代的反應。用亞硝酸做為亞硝化試劑,被強共軛給電子基團活化的苯環,例如酚、某些酚醚、萘酚、三級芳胺,在亞硝酸作用下,可發生親電取代的亞硝化反應。由於亞硝酸很不穩定,所以亞硝化一般採用亞硝酸鹽作為亞硝化劑。在反應中,先將反應物溶於酸(如鹽酸、稀硫酸、醋酸)中,再將亞硝酸鈉的水溶液逐滴加入到反應物中,使生成的亞硝酸立即與反應物作用。二級脂肪族胺和二級芳香族胺與亞硝酸反應,生成N-亞硝基二級胺。可用還原劑將亞硝基除掉,得回原來的二級胺。利用此性質,可以提純二級胺。一級胺在此反應條件下則發生重氮化反應。
反應機理
亞硝化反應通常是在水介質中、0℃C左右進行的,其實質是雙分子親電取代反應,其活潑質點是亞硝基離子NO+,但是NO+的親電能力不如NO2+,所以只能向芳環或其他電子密度大的碳原子進攻,即亞硝化的對象主要是酚類、芳仲胺、芳叔胺和某些多餘π電子的雜環以及具有活潑氫的脂肪族化合物。亞硝基主要進入芳環上羥基和叔氨基的對位,對位被占據時則進入鄰位。仲胺在亞硝化時,亞硝基優先進入氮原子上。
一般硝化反應過程如下:
 硝化反應過程
硝化反應過程芳仲胺的亞硝化
亞硝酸與芳仲胺反應時,生成N一亞硝基衍生物比生成C一亞硝基衍生物更容易。向芳仲胺的環上引入亞硝基,總是首先生N一亞硝基衍生物,然後在酸性介質中異構化,發生分子內重排反應而製得C一亞硝基衍生物。這一轉化反應的主要依據是可以在大過量的尿素存在下進行,被稱為Fischer—Hepp重排。
游離的芳仲胺C一亞硝基衍生物是呈雙極性離子存在的,因此,可以與酸或鹼作用生成相應的鹽(即單一離子產物),見下圖:
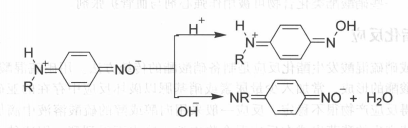 反應方程式
反應方程式對亞硝基二苯胺是製備橡膠防老劑4010NA的重要中間體,是二苯胺的N一亞硝基化合物通過重排製取的。而N一亞硝基二苯胺又是一種主要的橡膠硫化防焦劑、高效阻聚劑和醫藥中間體。
將NaNO2水溶液和硫酸水溶液與溶在三氯甲烷中的二苯胺作用,然後向三氯甲烷層中加入甲醇鹽酸,使其完成重排反應,得到對亞硝基二苯胺。後者用多硫化鈉還原得4一氨基二苯胺(見下圖)。
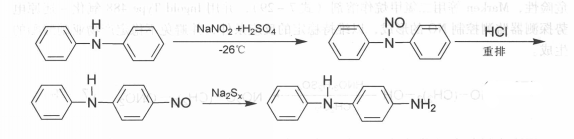 反應方程式
反應方程式但二苯胺價格貴,工業上在製備4一氨基二苯胺時用對硝基氯苯和甲醯苯胺的芳胺基化一還原法。現在正在開發對硝基氯苯和苯胺的芳胺基化一還原法,而最新的生產方法是硝基苯和苯胺混合物的液相催化法。
芳叔胺的亞硝化
向芳叔胺的環上引入亞硝基時,主要得到相應的對位取代產物。例如,對亞硝基—N,N一二甲基苯胺是製取染料、香料、醫藥和印染助劑及分析的重要中間體。
Ⅳ,N一二甲基苯胺鹽酸鹽稀水溶液約在0℃與微過量的NaNO2水溶液攪拌幾小時,即可製得亞硝基—N,N一二甲基苯胺鹽酸鹽,如下圖:
 反應方程式
反應方程式同法可以製得對亞硝基一N,N一二乙基苯胺等C一亞硝基芳叔胺衍生物。

