《一種高光學純度的核苷類中間體的製備方法》是合肥工業大學於2012年11月9日申請的專利,該專利申請號:2012104472765,專利公布號:CN102911167A,專利公布日:2013年2月6日,發明人是:馮乙巳、喬文龍、王唯丞、許皓誠。
《一種高光學純度的核苷類中間體的製備方法》公開了一種高光學純度的核苷類中間體的製備方法,包括光延反應、脫保護基反應、形成三氮唑的反應、氨化反應以及後處理各單元過程。該發明不經過複雜的醯基化或者氯化過程;避免了使用價格昂貴、用量大的有機矽試劑作為保護基團,降低了工藝成本。該發明生產工藝流程簡短,生產成本低,能夠得到高得率的高光學純度的中間體。
2021年8月16日,《一種高光學純度的核苷類中間體的製備方法》明獲得安徽省第八屆專利獎優秀獎。
基本介紹
- 中文名:一種高光學純度的核苷類中間體的製備方法
- 公布號:CN102911167A
- 公布日:2013年2月6日
- 申請號: 2012104472765
- 申請日:2012年11月9日
- 申請人:合肥工業大學
- 地址:安徽省合肥市屯溪路193號
- 發明人:馮乙巳、喬文龍、王唯丞、許皓誠
- Int.Cl.:C07D411/04(2006.01)I、C07D411/14(2006.01)I
- 專利代理機構:安徽省合肥新安專利代理有限責任公司
- 代理人:吳啟運
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,技術領域,權利要求,實施方式,榮譽表彰,
專利背景
核苷類藥物是一類重要的抗病毒類藥物。這類藥物在人體中,通過磷酸化後成為三磷酸核苷類藥物後,可以抑制病毒的DNA的逆轉錄酶的活性,同時三磷酸核苷類藥物還通過滲入病毒的DNA連,阻礙病毒的DNA連的合成,有效抑制病毒的複製而發揮有效的抗病毒活性。拉米夫定和恩曲他濱對免疫缺陷病(HIV)病毒和B型肝炎(HBV)病毒具有高效抗病毒作用,作為一類抗病毒藥物被廣泛套用。拉米夫定和恩曲他濱的化學結構式如下:

拉米夫定和恩曲他濱的化學結構式
截至2012年11月,這兩種核苷類藥物的製備方法中,都涉及到關鍵中間體化合物I的製備。化合物I的化學結構式如下:
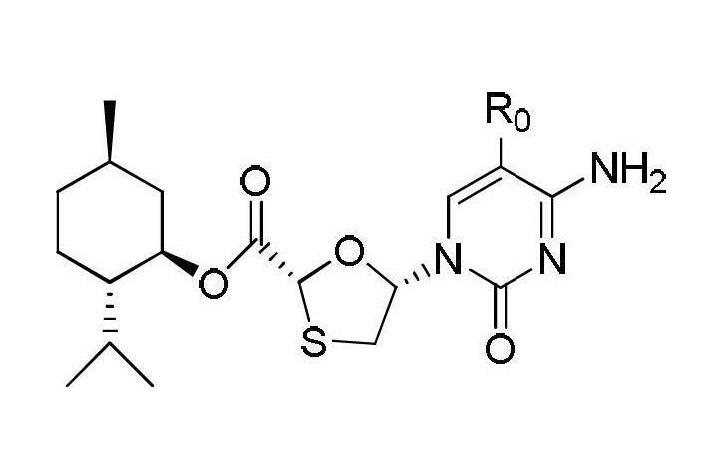
化合物I
CN102101856A公開了一種高光學純度核苷類中間體及其製備方法,主要是一種合成化合物I的方法以及合成化合物I前體化合物II的方法,化合物II其化學結構式如下:
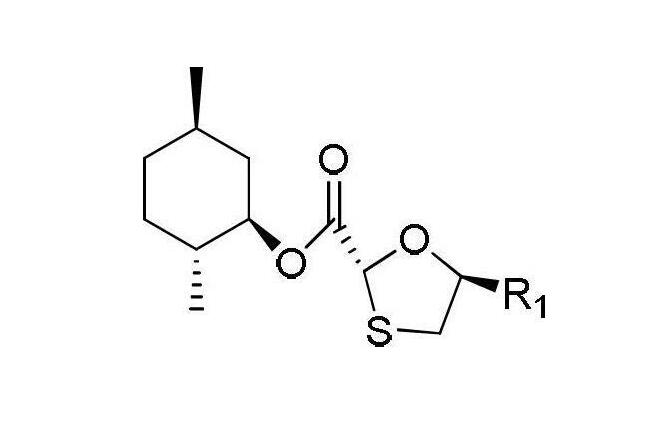
化合物II
其中R1為甲醯基、乙醯基、丙醯基、丁醯基、戊醯基、異丙醯基、異丁醯基、苯丙醯基或苯乙醯基,其中最優的為乙醯基和丙醯基。在製備化合物II時,首先由(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸-[(1'R,2‘S,5'R)-5'-甲基-2'-(1-甲基乙基)環己基]酯與醯基化試劑在-30~-5℃條件下經催化劑催化,得到化合物II。化合物II和矽烷基保護的胞嘧啶或者5-氟胞嘧啶通過糖基化反應,脫保護後得到化合物I。由於化合物II的製備需要在低溫條件下催化,保證手性碳不發生手性反轉而消旋化,條件苛刻,不利於工廠化生產,同時增加醯基化步驟,導致整個生產工藝路程過長,最終產率降低。由化合物II製備化合物I的反應中,用矽烷基保護的胞嘧啶或5-氟胞嘧啶。由於有機矽試劑昂貴,用量大,造成整個生產工藝成本高。CN101830893A公開了一種拉米夫定中間體HDMS的合成製備工藝,在製備(2R,5R)-5-(4-氨基-2-氧-2H-嘧啶-1-基)-[1,3]-噁噻烷-2-羧酸-2s-異丙基)-5R-甲基-1R-環乙酯由薄荷醇基-5-羥基-1,3-噻唑-2-羧酸酯在二氯甲烷和DMF的混合溶劑中通過緩慢滴加二氯亞碸,保溫常壓蒸餾3小時得到氯化產物薄荷醇基-5-氯-1,3-噻唑-2-羧酸酯,此過程中加入二氯亞碸遇水易分解成難聞的二氧化硫和鹽酸氣體,生成的酸也腐蝕設備;本身氯化的產率不高,再將氯化後的產物投入到下部反應,通過這兩步反應降低了整條反應的產率。再將反應容器中加入甲苯,六甲基二矽氮烷,胞嘧啶和薄荷醇基-5-氯-1,3-噻唑-2-羧酸酯,回流至澄清,結晶過濾得到產物HDMS。此過程中使用的六甲基二矽氮烷接觸空氣極易分解,同時有機矽試劑價格昂貴,使用量大,工藝成本高。兩步反應的產率為80%,產率不高。
CN1010669971A公開了恩曲他濱的非對應選擇性製備方法,提供了一條完整的恩曲他濱的合成路線。其中關鍵中間體5S-(5'-氟胞嘧啶)-1,3-氧硫雜環戊烷-2R-羧酸-L-薄荷醇酯是由反式-5-羥基-1,3-氧硫雜環戊烷-2-羧酸-L薄荷醇酯在無水二氯甲烷和無水N,N-二甲基甲醯胺溶液中,逐漸滴加二氯亞碸氯化得到反式-5-羥基-1,3-氧硫雜環戊烷-2-羧酸-L薄荷醇酯後,將其緩慢加入5-氟胞嘧啶,硫酸銨,二氯甲烷,六甲基二矽氮烷,三乙胺的混合溶液中回流14小時。使用六甲基二矽氮烷價格昂貴,用量大,同時六甲基二矽氮烷易變質。總的來說,2012年11月以前的技術中化合物I主要是通過對反式-5-羥基-1,3-氧硫雜環戊烷-2-羧酸-L薄荷醇酯的氯化或者醯基化,再與胞嘧啶和5-氟胞嘧啶或者是用有機矽保護的胞嘧啶和5-氟胞嘧啶通過偶聯反應,而氯化或者醯基化過程對手性結構的保持有較高要求,同時延長了工藝流程,增加工藝成本,降低了最終產物的得率。對於拉米夫定或者恩曲他濱嘧啶基團的引入都是通過矽烷基保護的胞嘧啶或5-氟胞嘧啶,由於矽烷基昂貴,用量大,同時有機矽試劑不穩定,造成整個生產工藝的成本較大。
發明內容
專利目的
《一種高光學純度的核苷類中間體的製備方法》旨在提供一種高光學純度的核苷類中間體的製備方法,所要解決的技術問題是簡化2012年11月以前技術的生產工藝,降低生產成本,提高產率。
技術方案
《一種高光學純度的核苷類中間體的製備方法》包括光延反應、脫保護基反應、形成三氮唑的反應、氨化反應以及後處理各單元過程:所述光延反應是以(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯和3-苄基-2,4-(1H,3H)-嘧啶二酮為原料,在偶氮試劑和三元取代膦的存在下於溶劑中0-50℃反應8-24小時得到中間體I[(2R,5R)-5-羥基-(3-苄基-2,4-(1H,3H)-嘧啶二酮-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯];(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯和3-苄基-2,4-(1H,3H)-嘧啶二酮的摩爾比為1:1-10;所述偶氮試劑選自偶氮二甲酸二異丙酯、偶氮二甲酸二乙酯、偶氮二甲醯二哌啶或偶氮二甲醯胺,偶氮試劑的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-20;所述三元取代膦選自三苯基膦、三正丁基膦、三甲基膦、三環己基膦或三辛酸基膦,三元取代膦的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-10;所述溶劑選自1,2-氯乙烷、1,1-二氯乙烷、三氯甲烷、四氯化碳、四氫呋喃中的一種或幾種;所述脫保護基反應是將所述中間體I置於鹼的醇溶液中在氬氣保護下於室溫下攪拌0.5-4小時得到中間體II[(2R,5R)-5-羥基-(尿嘧啶-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯];所述形成三氮唑的反應是向溶劑中加入中間體II、1,2,4-三氮唑和三氯氧磷,在有機鹼的存在下於0-60℃反應14-24小時得到三氮唑類化合物即為中間體III;中間體II和1,2,4-三氮唑的摩爾比為1:1-10,中間體II和三氯氧磷的摩爾比為1:0.5-5,三氯氧磷和有機鹼的摩爾比為1:1-10;所述溶劑選自無水乙腈、丙腈、N,N′-二甲基甲醯胺、1,4-二氧六環、1,2-二氯乙烷、三氯乙烷或四氯化碳;所述有機鹼選自三乙醇胺、三乙胺、乙二胺或二異丙胺;所述氨化反應是將0.1摩爾的中間體III溶解於溶劑中,再加入質量濃度為25-30%的氨水溶液20-50毫升,於0-80℃反應14-25小時得到目標產物化合物I,化學名稱(2R,5R)-5-羥基-(胞嘧啶-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯,為拉米夫定的中間體;所述溶劑選自1,4-二氧六環、N,N′-二甲基甲醯胺或四氫呋喃;所述溶劑和所述氨水溶液的體積比為2:0.5-4。
光延反應中所述偶氮試劑為偶氮二甲酸二異丙酯,偶氮試劑的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-10;光延反應中所述三元取代膦為三苯基膦,三元取代膦的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-3;光延反應中所述溶劑為四氫呋喃,反應溫度為30℃,反應時間為10小時。脫保護基反應中所述鹼的醇溶液為質量濃度為1-50%的甲醇鈉、甲醇鎂、叔丁醇鈉、叔丁醇鉀、甲醇鈣、氫氧化鋰、氫氧化鉀或氫氧化鈉的甲醇溶液或為飽和氨氣的甲醇溶液。形成三氮唑的反應中所述溶劑為無水乙腈,所述有機鹼為三乙醇胺,反應溫度為30℃,反應時間為16小時。氨化反應中反應溫度為30℃,所述溶劑選自1,4-二氧六環,所述溶劑和所述氨水溶液的體積比為2:1。該發明高光學純度的核苷類中間體的製備方法,包括光延反應、脫保護基反應、形成三氮唑的反應、氨化反應以及後處理各單元過程:所述光延反應是以(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯和3-苄基-5-氟-2,4-(1H,3H)-嘧啶二酮為原料,在偶氮試劑和三元取代膦的存在下於溶劑中0-50℃反應8-24小時得到中間體I[(2R,5R)-5-羥基-(3-苄基-5-氟-2,4-(1H,3H)-嘧啶二酮-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯];(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯和3-苄基-5-氟-2,4-(1H,3H)-嘧啶二酮的摩爾比為1:1-10;所述偶氮試劑選自偶氮二甲酸二異丙酯、偶氮二甲酸二乙酯、偶氮二甲醯二哌啶或偶氮二甲醯胺,偶氮試劑的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-20;所述三元取代膦選自三苯基膦、三正丁基膦、三甲基膦、三環己基膦或三辛酸基膦,三元取代膦的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-10;所述溶劑選自1,2-氯乙烷、1,1-二氯乙烷、三氯甲烷、四氯化碳、四氫呋喃中的一種或幾種;所述脫保護基反應是將所述中間體I置於鹼的醇溶液中在氬氣保護下於室溫下攪拌0.5-4小時得到中間體II[(2R,5R)-5-羥基-(5-氟-尿嘧啶-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯];所述形成三氮唑的反應是向溶劑中加入中間體II、1,2,4-三氮唑和三氯氧磷,在有機鹼的存在下於0-60℃反應14-24小時得到三氮唑類化合物即為中間體III;中間體II和1,2,4-三氮唑的摩爾比為1:1-10,中間體II和三氯氧磷的摩爾比為1:0.5-5,三氯氧磷和有機鹼的摩爾比為1:1-10;所述溶劑選自無水乙腈、丙腈、N,N′-甲基甲醯胺、1,4-二氧六環、1,2-二氯乙烷、三氯乙烷或四氯化碳;所述有機鹼選自三乙醇胺、三乙胺、乙二胺或二異丙胺;所述氨化反應是將0.1摩爾的中間體III溶解於溶劑中,再加入質量濃度為25-30%的氨水溶液20-50毫升,於0-80℃反應14-25小時得到目標產物化合物I,化學名稱(2R,5R)-5-羥基-(5-氟-胞嘧啶-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯,為恩曲他濱的中間體;所述溶劑選自1,4-二氧六環、N,N′-二甲基甲醯胺或四氫呋喃;所述溶劑和所述氨水溶液的體積比為2:0.5-4。
光延反應中所述偶氮試劑為偶氮二甲酸二異丙酯,偶氮試劑的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-10;光延反應中所述三元取代膦為三苯基膦,三元取代膦的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-3;光延反應中所述溶劑為四氫呋喃,反應溫度為30℃,反應時間為10小時。脫保護基反應中所述鹼的醇溶液為質量濃度為1-50%的甲醇鈉、甲醇鎂、叔丁醇鈉、叔丁醇鉀、甲醇鈣、氫氧化鋰、氫氧化鉀或氫氧化鈉的甲醇溶液或為飽和氨氣的甲醇溶液。形成三氮唑的反應中所述溶劑為無水乙腈,所述有機鹼為三乙醇胺,反應溫度為30℃,反應時間為16小時。氨化反應中反應溫度為30℃,所述溶劑選自1,4-二氧六環,所述溶劑和所述氨水溶液的體積比為2:1。該發明反應路線如下: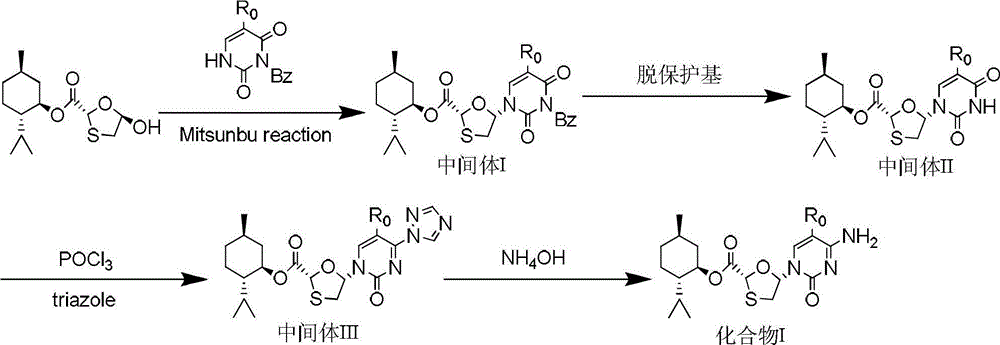

當化合物I中R0為H時即為拉米夫定的中間體,當化合物I中R0為F時即為恩曲他濱的中間體。該發明不經過複雜的醯基化或者氯化過程;避免了使用價格昂貴、用量大的有機矽試劑作為保護基團,降低了工藝成本。該發明生產工藝流程簡短,生產成本低,能夠得到高得率的高光學純度的中間體—化合物I。
改善效果
《一種高光學純度的核苷類中間體的製備方法》工藝簡單,成本低,得率高,產物光學純度高,污染小,適用於工業生產。
技術領域
《一種高光學純度的核苷類中間體的製備方法》涉及一種抗病毒藥物中間體的製備方法,具體地說是一種高光學純度的核苷類中間體的製備方法。
權利要求
1.《一種高光學純度的核苷類中間體的製備方法》包括光延反應、脫保護基反應、形成三氮唑的反應、氨化反應以及後處理各單元過程,其特徵在於:所述光延反應是以(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯和3-苄基-2,4-(1H,3H)-嘧啶二酮為原料,在偶氮試劑和三元取代膦的存在下於溶劑中0-50℃反應8-24小時得到中間體I;(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯和3-苄基-2,4-(1H,3H)-嘧啶二酮的摩爾比為1:1-10;所述偶氮試劑選自偶氮二甲酸二異丙酯、偶氮二甲酸二乙酯、偶氮二甲醯二哌啶或偶氮二甲醯胺,偶氮試劑的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-20;所述三元取代膦選自三苯基膦、三正丁基膦、三甲基膦、三環己基膦或三辛酸基膦,三元取代膦的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-10;所述溶劑選自1,2-氯乙烷、1,1-二氯乙烷、三氯甲烷、四氯化碳、四氫呋喃中的一種或幾種;所述脫保護基反應是將所述中間體I置於鹼的醇溶液中在氬氣保護下於室溫下攪拌0.5-4小時得到中間體II;所述形成三氮唑的反應是向溶劑中加入中間體II、1,2,4-三氮唑和三氯氧磷,在有機鹼的存在下於0-60℃反應14-24小時得到三氮唑類化合物即為中間體III;中間體II和1,2,4-三氮唑的摩爾比為1:1-10,中間體II和三氯氧磷的摩爾比為1:0.5-5,三氯氧磷和有機鹼的摩爾比為1:1-10;所述溶劑選自無水乙腈、丙腈、N,N′-二甲基甲醯胺、1,4-二氧六環、1,2-二氯乙烷、三氯乙烷或四氯化碳;所述有機鹼選自三乙醇胺、三乙胺、乙二胺或二異丙胺;所述氨化反應是將0.1摩爾的中間體III溶解於溶劑中,再加入質量濃度為25-30%的氨水溶液20-50毫升,於0-80℃反應14-25小時得到目標產物化合物I,為拉米夫定的中間體;所述溶劑選自1,4-二氧六環、N,N′-二甲基甲醯胺或四氫呋喃;所述溶劑和所述氨水溶液的體積比為2:0.5-4。
2.根據權利要求1所述的製備方法,其特徵在於:光延反應中所述偶氮試劑為偶氮二甲酸二異丙酯,偶氮試劑的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-10;光延反應中所述三元取代膦為三苯基膦,三元取代膦的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-3;光延反應中所述溶劑為四氫呋喃,反應溫度為30℃,反應時間為10小時。
3.根據權利要求1所述的製備方法,其特徵在於:脫保護基反應中所述鹼的醇溶液為質量濃度為1-50%的甲醇鈉、甲醇鎂、叔丁醇鈉、叔丁醇鉀、甲醇鈣、氫氧化鋰、氫氧化鉀或氫氧化鈉的甲醇溶液或為飽和氨氣的甲醇溶液。
4.根據權利要求1所述的製備方法,其特徵在於:形成三氮唑的反應中所述溶劑為無水乙腈,所述有機鹼為三乙醇胺,反應溫度為30℃,反應時間為16小時。
5.根據權利要求1所述的製備方法,其特徵在於:氨化反應中反應溫度為30℃,所述溶劑選自1,4-二氧六環,所述溶劑和所述氨水溶液的體積比為2:1。
6.一種高光學純度的核苷類中間體的製備方法,包括光延反應、脫保護基反應、形成三氮唑的反應、氨化反應以及後處理各單元過程,其特徵在於:所述光延反應是以(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯和3-苄基-5-氟-2,4-(1H,3H)-嘧啶二酮為原料,在偶氮試劑和三元取代膦的存在下於溶劑中0-50℃反應8-24小時得到中間體I;(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯和3-苄基-5-氟-2,4-(1H,3H)-嘧啶二酮的摩爾比為1:1-10;所述偶氮試劑選自偶氮二甲酸二異丙酯、偶氮二甲酸二乙酯、偶氮二甲醯二哌啶或偶氮二甲醯胺,偶氮試劑的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-20;所述三元取代膦選自三苯基膦、三正丁基膦、三甲基膦、三環己基膦或三辛酸基膦,三元取代膦的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-10;所述溶劑選自1,2-氯乙烷、1,1-二氯乙烷、三氯甲烷、四氯化碳、四氫呋喃中的一種或幾種;所述脫保護基反應是將所述中間體I置於鹼的醇溶液中在氬氣保護下於室溫下攪拌0.5-4小時得到中間體II;所述形成三氮唑的反應是向溶劑中加入中間體II、1,2,4-三氮唑和三氯氧磷,在有機鹼的存在下於0-60℃反應14-24小時得到三氮唑類化合物即為中間體III;中間體II和1,2,4-三氮唑的摩爾比為1:1-10,中間體II和三氯氧磷的摩爾比為1:0.5-5,三氯氧磷和有機鹼的摩爾比為1:1-10;所述溶劑選自無水乙腈、丙腈、N,N′-二甲基甲醯胺、1,4-二氧六環、1,2-二氯乙烷、三氯乙烷或四氯化碳;所述有機鹼選自三乙醇胺、三乙胺、乙二胺或二異丙胺;所述氨化反應是將0.1摩爾的中間體III溶解於溶劑中,再加入質量濃度為25-30%的氨水溶液20-50毫升,於0-80℃反應14-25小時得到目標產物化合物I,為恩曲他濱的中間體;所述溶劑選自1,4-二氧六環、N,N′-二甲基甲醯胺或四氫呋喃;所述溶劑和所述氨水溶液的體積比為2:0.5-4。
7.根據權利要求6所述的製備方法,其特徵在於:光延反應中所述偶氮試劑為偶氮二甲酸二異丙酯,偶氮試劑的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-10;光延反應中所述三元取代膦為三苯基膦,三元取代膦的摩爾量與(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯摩爾量之比為1:1-3;光延反應中所述溶劑為四氫呋喃,反應溫度為30℃,反應時間為10小時。
8.根據權利要求6所述的製備方法,其特徵在於:脫保護基反應中所述鹼的醇溶液為質量濃度為1-50%的甲醇鈉、甲醇鎂、叔丁醇鈉、叔丁醇鉀、甲醇鈣、氫氧化鋰、氫氧化鉀或氫氧化鈉的甲醇溶液或為飽和氨氣的甲醇溶液。
9.根據權利要求6所述的製備方法,其特徵在於:形成三氮唑的反應中所述溶劑為無水乙腈,所述有機鹼為三乙醇胺,反應溫度為30℃,反應時間為16小時。
10.根據權利要求6所述的製備方法,其特徵在於:氨化反應中反應溫度為30℃,所述溶劑選自1,4-二氧六環,所述溶劑和所述氨水溶液的體積比為2:1。
實施方式
- 實施例1
拉米夫定的中間體的合成(1)中間體I一(2R,5R)-5-羥基-(3-苄基-2,4-(1H,3H)-嘧啶二酮-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯的合成
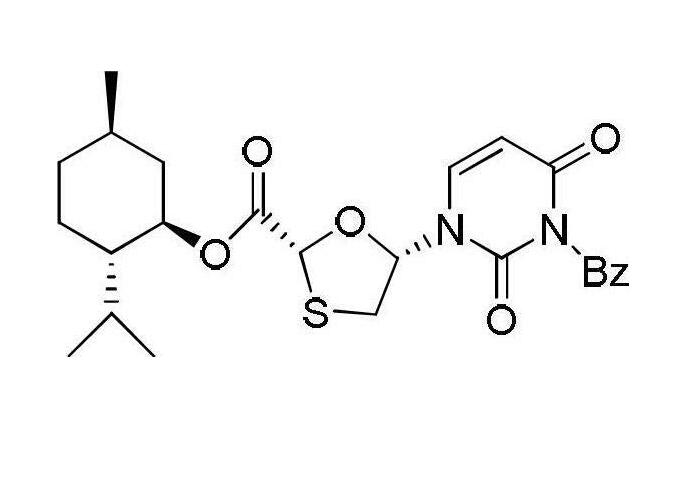
中間體I
將(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯28.814克(0.1摩爾)、3-苄基-2,4-(1H,3H)-嘧啶二酮21.90克(0.1摩爾)和三苯基膦26.229克(0.1摩爾)加入四氫呋喃中,再將溶解了偶氮二甲酸二異丙酯20.02克(0.1摩爾)的250毫升四氫呋喃溶液緩慢加入,0℃條件下攪拌半小時,再在室溫條件下反應10小時,用薄層色譜檢測反應過程,反應完成後,向反應體系中加入50毫升飽和氯化鈉溶液攪拌,再用乙酸乙酯(100毫升x3)萃取反應混合溶液,分液去水相,有機相混合後再用水洗滌並乾燥,濃縮有機相,脫去部分溶劑,然後在-5~0℃下冷凍結晶,過濾並乾燥得到中間體I固體39.62克,收率為89%,所得固體直接用於下一步反應。
(2)中間體II—(2R,5R)-5-羥基-(尿嘧啶-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯的合成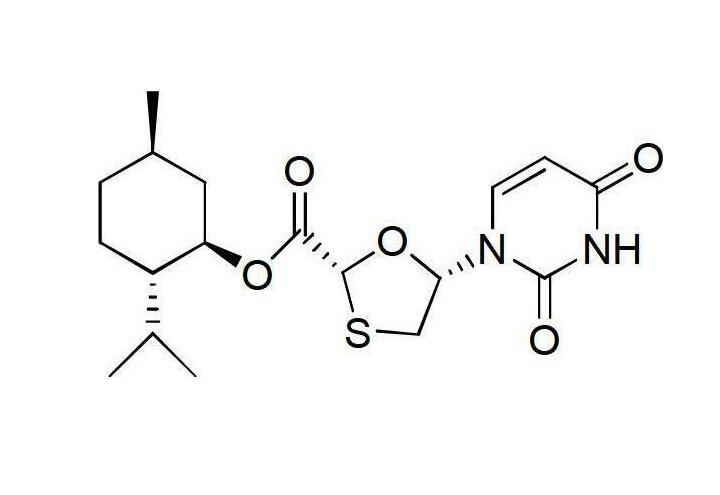

中間體II
在氬氣保護下將中間體I的48.2克(0.1摩爾)加到85毫升的甲醇鎂的甲醇溶液(質量濃度為3.5%)中,室溫條件反應半小時,用薄層色譜檢測反應進程,反應結束後加入20毫升水和50毫升乙酸乙酯,攪拌均勻後靜置分液;有機相依次用稀鹽酸(質量濃度為5%)洗滌一次和50毫升蒸餾水洗滌2次至有機相為中性,乾燥有機相後,蒸餾去除部分溶劑,然後在-5~0℃下冷凍結晶,過濾並乾燥得中間體II固體33.3克,收率為80%,將所得固體直接用於下一步反應。
(3)中間體III—三氮唑類化合物的合成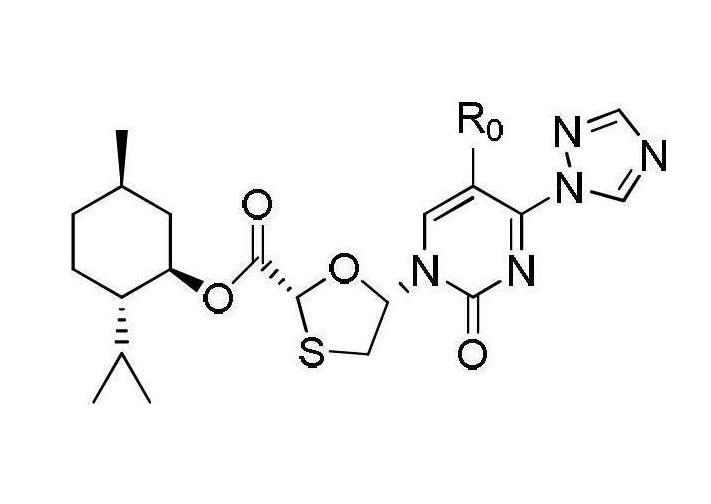

中間體III
在0℃時將1,2,4-三氮唑17.3克(0.25摩爾)加入到100毫升的經乾燥脫水的乙腈中,攪拌溶解,隨後依次加入三氯氧磷9.16毫升(0.1摩爾)和三乙醇胺83.5毫升(0.6摩爾),再攪拌2小時;將溶解了中間體II(38.22克,0.1摩爾)的乙腈溶液緩慢滴加入反應液中,30℃反應16小時;反應結束後加入100毫升飽和氯化鈉溶液,攪拌均勻後靜置分液,有機相依次用稀鹽酸(質量濃度為5%)洗滌一次和蒸餾水洗滌2次至有機相為中性,乾燥有機相後脫去部分溶劑,然後在-5~0℃下冷凍結晶,過濾並乾燥後得到中間體III固體37.25克,收率為86%,將所得固體直接用於下一反應。(4)目標產物—化合物I(2R,5R)-5-羥基-(胞嘧啶-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯的合成—拉米夫定的中間體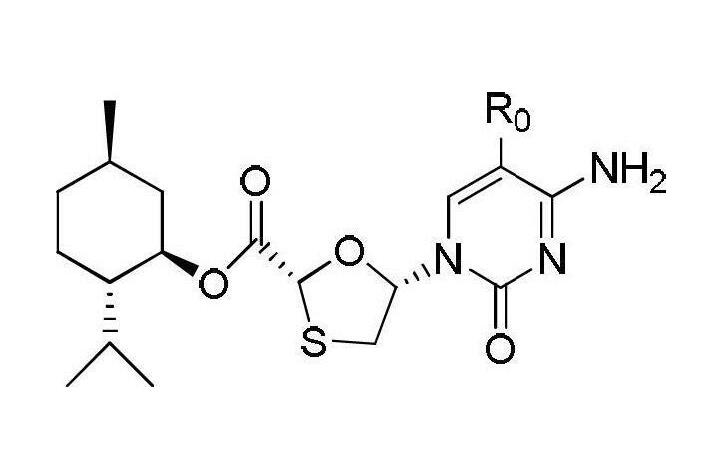

化合物I
將中間體III(43.32克,0.1摩爾)溶解在體積比為2:1的1,4-二氧六環和質量濃度28%的氨水溶液的200毫升混合溶液中,30℃條件下攪拌反應16小時,反應結束後加入100毫升飽和氯化鈉溶液,攪拌後靜置分液,依次用稀鹽酸(質量濃度為5%)洗滌有機相溶液和蒸餾水洗滌至有機相溶液為中性。乾燥有機相後脫去部分溶劑,殘留物在-5~0℃下冷凍結晶,最後過濾乾燥得到固體33.92克即為目標產物化合物I,得率為89%。HPLC純度為98.5%,手性純度為98.2%,熔點為216.8-217.8℃。1H-NMR(CDCl3)δ。
- 實施例2
恩曲他濱的中間體的合成(1)中間體I—(2R,5R)-5-羥基-(3-苄基-5-氟-2,4-(1H,3H)-嘧啶二酮-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯的合成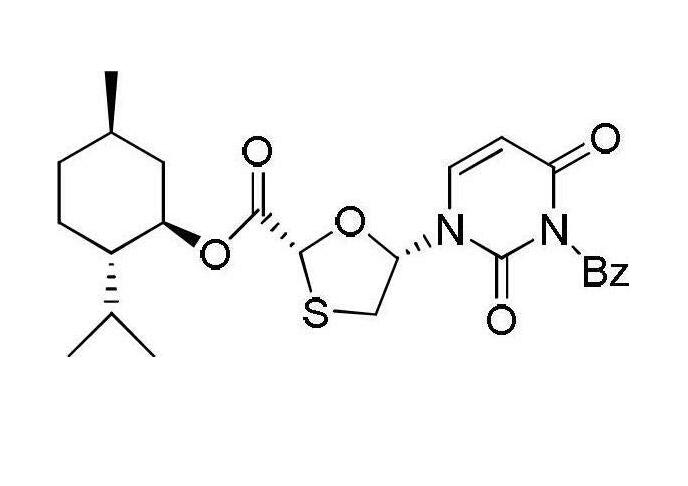

中間體I
將(2R,5R)-5-羥基-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯28.814克(0.1摩爾)、3-苄基-5-氟-2,4-(1H,3H)-嘧啶二酮23.40克(0.1摩爾)和三苯基膦26.229克(0.1摩爾)溶解在四氫呋喃中,再將溶解了20.02克偶氮二甲酸二異丙酯(0.1摩爾)的250毫升四氫呋喃溶液緩慢加入,0℃下攪拌半小時,再在室溫條件下反應10小時,用薄層色譜檢測反應過程,反應完成後,向反應體系中加入50毫升飽和氯化鈉溶液攪拌均勻,再用乙酸乙酯(100毫升x3)萃取反應混合溶液,分液去水相,有機相混合後再用水洗滌並乾燥,濃縮有機相,脫去部分溶劑,在-5~0℃條件下冷凍結晶,過濾乾燥後得到固體43.89克即為中間體I,收率為87%,將所得固體直接用於下一步反應。(2)中間體II—(2R,5R)-5-羥基-(3-苄基-5-氟-2,4-(1H,3H)-嘧啶二酮-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯的合成
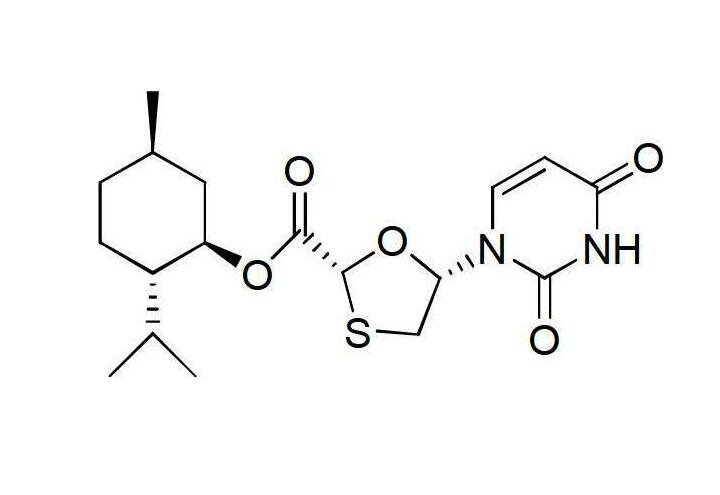
中間體II
在氬氣環境中將中間體I 50.42克(0.1摩爾)加到85毫升的甲醇鎂的甲醇溶液(質量濃度為3.5%)中,室溫條件反應半小時,用薄層色譜檢測反應進程,反應結束後加入20毫升水和50毫升乙酸乙酯,攪拌後靜置分液;有機相依次用稀鹽酸(質量濃度為5%)洗滌一次和50毫升蒸餾水洗滌2次至有機相為中性,乾燥有機相後,蒸餾去除部分溶劑,然後在-5~0℃條件下冷凍結晶,過濾乾燥得固體33.20克即為中間體II,得率為83%,直接將所得固體用於下一步反應。(3)中間體III—三氮唑類化合物的合成
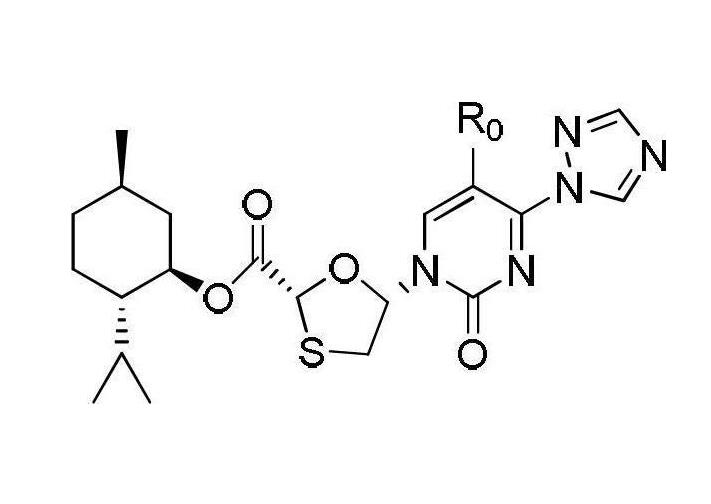
中間體III
在0℃時將1,2,4-三氮唑17.3克(0.25摩爾)加入到100毫升的經乾燥脫水的乙腈中,攪拌均勻,隨後依次加入三氯氧磷9.16毫升(0.1摩爾)和三乙醇胺83.5毫升(0.6摩爾),攪拌2小時,將溶解在乙腈中的中間體II(以中間體II計40.2克,0.1摩爾)乙腈溶液緩慢滴加入反應液中,30℃反應16小時;反應結束後加入100毫升飽和氯化鈉溶液,攪拌後靜置分液,有機相依次用稀鹽酸(質量濃度為5%)洗滌一次和蒸餾水洗滌2次至有機相為中性。乾燥有機相後脫去部分溶劑,然後在-5~0℃條件下冷凍結晶,過濾乾燥得到固體37.25克即為中間體III,收率為86%。乾燥後得到固體40.5克即為中間體III,得率為90%,將所得固體直接用於下一步反應。(4)目標產物—化合物I(2R,5R)-5-羥基-(5-氟-胞嘧啶-1-基)-[1,3]氧硫雜環戊烷-2-羧酸(2S-異丙基-5R-甲基-1R-環己基)酯的合成—恩曲他濱的中間體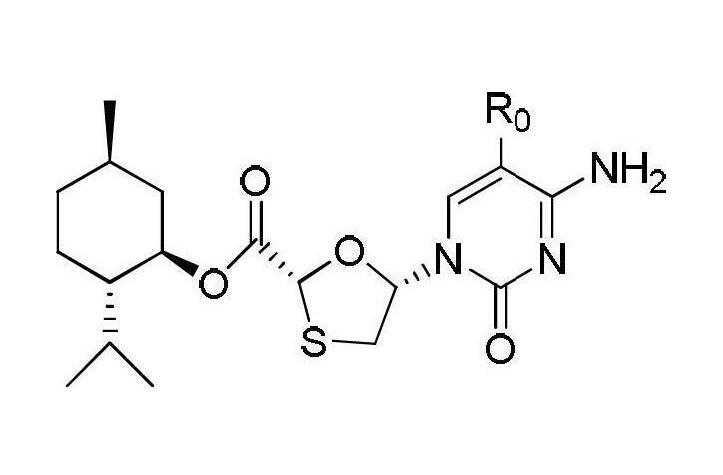

化合物I
將中間體III(45.1克,0.1摩爾)溶解在體積比為2:1的1,4-二氧六環和質量濃度28%的氨水溶液的200毫升混合溶液中,30℃條件下攪拌反應16小時,反應結束後加入100毫升飽和氯化鈉溶液,攪拌後靜置分液,依次用稀鹽酸(質量濃度為5%)洗滌有機相溶液和蒸餾水洗滌至有機相溶液為中性,乾燥有機相後脫去部分溶劑,然後在-5~0℃下條件下冷凍結晶,最後過濾乾燥得到固體36.34克即為目標產物化合物I,得率為91.0%。其HPLC的純度為98.4%,手性純度為97.5%。熔點為151-153℃。1H-NMR(CDCl3)δ:0.80(d,3H,5’-CH3),0.90(t,6H,2’-CH3),1,03~2.04(m,9H,2’~6’-H,2’-CH-),3.12(dd,1H,4-H),3.52(dd,1H,4-H),4.78(dt,1H,1’-H),5.46(s,1H,2-H),5.55(brs,1H,NH),6.42(t,1H,5-H),7.47(brs,1H,NH),8.51(d,1H,Ar-H)。
榮譽表彰
2021年8月16日,《一種高光學純度的核苷類中間體的製備方法》獲得安徽省第八屆專利獎優秀獎。

