專利背景
以小牛血清為原料經過除蛋白後得到的提取物具有改善細胞代謝的生理作用,在臨床上廣泛套用於神經科疾病的治療。截至2008年5月,所有的小牛血清類產品的研究都認為小分子肽是這類產品的主要有效成份,因此所有的產品提取工藝都將提高小分子肽含量作為目標,在生產工藝中使用酸解、酶解等技術將大分子蛋白及多肽切成小分子肽;還有些產品將控制小分子肽含量作為控制有效成分的手段。
發明內容
專利目的
《一種小牛血清去蛋白注射液及其生產方法》的目的是提供一種小牛血清去蛋白注射液及其生產方法。
技術方案
《一種小牛血清去蛋白注射液及其生產方法》所提供的小牛血清去蛋白注射液的製備方法,包括如下步驟:
1)去除小牛血清中的蛋白,然後進行粗濾,收集濾液;
2)對所述濾液依次用甲苯、乙酸乙酯和正丁醇進行萃取,每次萃取中棄去有機相保留水相;
3)對所述水相採用BIO-GEL-P2凝膠進行層析,以純化水為流動相,收集280納米檢測波長的吸光度曲線上的第二吸收峰,得到小牛血清去蛋白注射液。
所述製備方法中還包括將所得到的小牛血清去蛋白注射液進行病毒滅活的步驟。增加病毒滅活步驟可殺滅非脂包膜病毒和脂包膜病毒,保證產品的生物安全性。所述病毒滅活條件為60℃水浴中保存10小時。
上述步驟2)中,加入的甲苯、乙酸乙酯和正丁醇的體積均大於等於所述濾液的體積。當所述BIO-GEL-P2凝膠層析中柱床高度為120-140厘米,柱的直徑為4-5厘米,所述純化水的洗脫流速為40毫升/時。
由所述的製備方法製備的小牛血清去蛋白注射液也屬於《一種小牛血清去蛋白注射液及其生產方法》的保護範圍。
所述方法製備的小牛血清去蛋白注射液的活性成分為多糖,所述多糖的含量為1.0-1.2毫克/毫升,優選為1.17毫克/毫升。除所述多糖外,所述注射液中還含有小分子肽類物質;所述小分子肽類物質含量為小於等於0.05毫克/毫升,優選為0.04毫克/毫升。
《一種小牛血清去蛋白注射液及其生產方法》所述的小牛血清去蛋白注射液可用於治療如下疾病:
a)腦缺血缺氧性疾病;
b)營養障礙性疾病所引起的神經功能缺損(缺血性損害、顱腦外傷);
c)末梢動脈循環障礙及其引起的動脈血管病;
d)靜脈循環障礙及其引起的動脈血管病;
e)皮膚燒傷、燙傷、糜爛(創傷、褥瘡);放射所致的皮膚、黏膜損傷;
e)老年痴呆;
《一種小牛血清去蛋白注射液及其生產方法》所述的小牛血清去蛋白注射液還可促進傷口癒合,可在皮膚移植術中套用。
對不同患者可依據不同病情給予有效治療量的小牛血清去蛋白注射液,如每日3次,每次10毫升靜脈滴注。
改善效果
《一種小牛血清去蛋白注射液及其生產方法》的發現存在於小牛血清中的天然多糖的生物活性遠遠高於小分子肽。它改變了以往對小牛血清類產品的認識,證明了多糖的生物活性比小分子肽更強,而且二者存在競爭性抑制。因此,該發明改進了製備小牛血清去蛋白注射液的方法,改變了傳統的提取方法把增加小分子肽作為目標的技術方向,通過萃取和層析步驟,使多糖成為所製備的產品的主要有效成分。這種製備方法,通過萃取去除了低極性的酯類等雜質,提高純度;通過層析去除了高極性的肽類雜質,解除其對於多糖活性的競爭性抑制,使產品生物活性進一步提高,療效更好。該發明產品的主要有效成分是多糖,除多糖外小分子肽類物質的含量極低,因此,不容易發生聚合反應,增加了產品的穩定,同時減少了小分子肽類物質的含量,使發生過敏反應的幾率大大降低,產品更加安全;並且產品的呼吸活性指數由3.0左右提高到7.0以上,產品療效進一步提高。該發明所述的小牛血清去蛋白注射液可在腦部缺血性損害,動脈血管病,燒傷等疾病的治療中套用。
附圖說明
圖1為吸光度曲線;
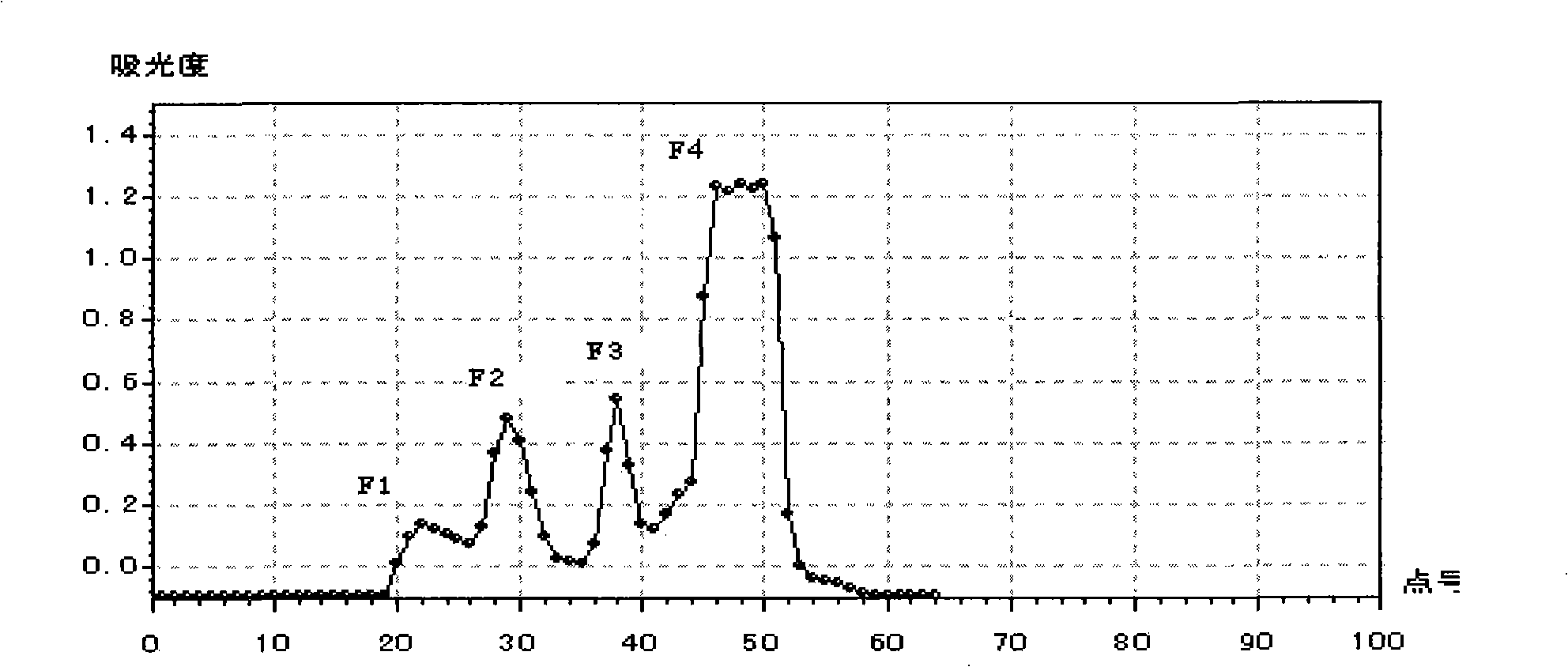
圖1
圖2為小牛血清去蛋白注射液的高效液相色譜圖。
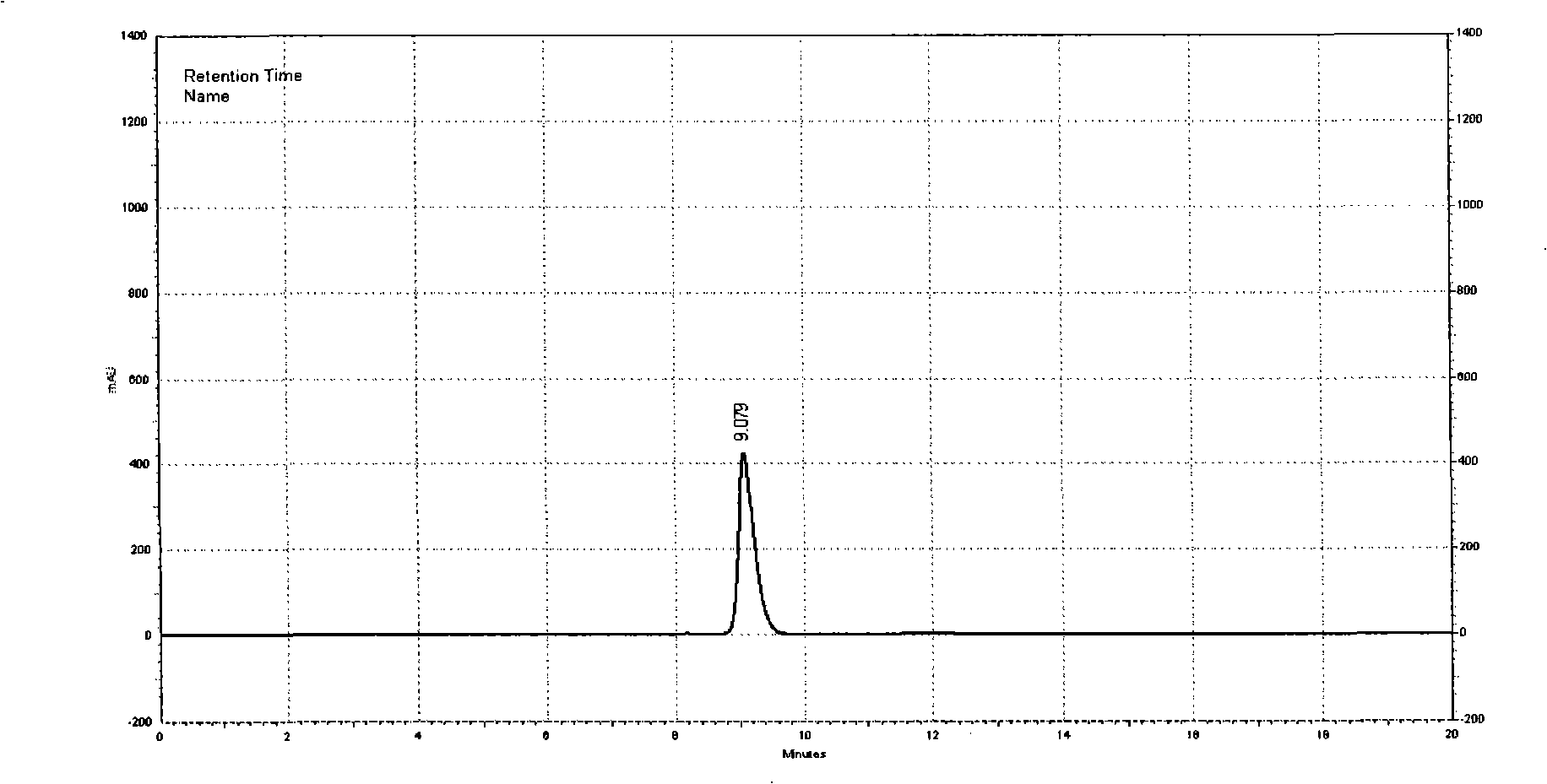
圖2
技術領域
《一種小牛血清去蛋白注射液及其生產方法》涉及一種小牛血清去蛋白注射液及其生產方法。
權利要求
1、一種小牛血清去蛋白注射液的製備方法,包括如下步驟:1)去除小牛血清中的蛋白,然後進行粗濾,收集濾液;2)對所述濾液依次用甲苯、乙酸乙酯和正丁醇進行萃取,每次萃取中棄去有機相保留水相;3)對所述水相採用BIO-GEL-P2凝膠進行層析,以純化水為流動相,收集280納米檢測波長的吸光度曲線上的第二吸收峰,得到小牛血清去蛋白注射液。
2、根據權利要求1所述的方法,其特徵在於:所述製備方法中還包括將所得到的小牛血清去蛋白注射液進行病毒滅活的步驟。
3、根據權利要求2所述的方法,其特徵在於:所述病毒滅活為60℃水浴中保存10小時。
4、根據權利要求1或2或3所述的方法,其特徵在於:所述步驟2)中,加入的甲苯、乙酸乙酯和正丁醇的體積均大於等於所述濾液的體積。
5、根據權利要求1或2或3所述的方法,其特徵在於:所述BIO-GEL-P2凝膠層析中柱床高度為120-140厘米,柱的直徑為4-5厘米;所述純化水的洗脫流速為40毫升/時。
6、由權利要求1至5任一所述的製備方法製備的小牛血清去蛋白注射液。
7、根據權利要求6所述的小牛血清去蛋白注射液,其特徵在於:所述小牛血清去蛋白注射液的活性成分為多糖,所述多糖的含量為1.0-1.2毫克/毫升,優選為1.17毫克/毫升。
8、根據權利要求7所述的小牛血清去蛋白注射液,其特徵在於:所述注射液中還含有小分子肽類物質;所述小分子肽類物質含量為小於等於0.05毫克/毫升,優選為0.04毫克/毫升。
實施方式
生產方法
《一種小牛血清去蛋白注射液及其生產方法》的小牛血清去蛋白注射液的生產方法如下:
除蛋白:按照乙醇和血清比例為2:1的量向血清中加入96%的乙醇,離心(4000轉/分,10分鐘)後留上清棄沉澱。利用真空旋轉蒸發儀,37℃,1個大氣壓減壓除乙醇,蒸發至血清體積的60%。
粗濾:用截留分子量100000D的中空纖維柱粗濾,收集濾液。
萃取:依次加入甲苯、乙酸乙酯、正丁醇萃取,每次都是除掉有機溶劑保留水溶液。
層析:將萃取所得溶液濃縮至初始血清體積的1/10,用BIO-GEL-P2凝膠層析分離。
上述BIO-GEL-P2凝膠層析的收集液,即為小牛血清去蛋白提取液。
病毒滅活:上述提取液在60℃水浴中保存10小時,殺滅病毒。
小牛血清去蛋白提取液經病毒滅活後,再經過0.2微米孔徑的微孔濾膜過濾,無菌操作分裝至清洗乾淨的5毫升安瓿中,充氮封口,即得小牛血清去蛋白注射液。
實施案例
下面通過實施例具體闡明《一種小牛血清去蛋白注射液及其生產方法》的技術方案。
a)生產小牛血清去蛋白注射液
(1)除蛋白:取小牛血清1000毫升(購於內蒙科左中旗錦康牛製品開發有限公司),加入2000毫升96%的乙醇,混勻後,靜置30分鐘;離心(4000轉/分,10分鐘)後留上清,棄沉澱;利用真空旋轉蒸發儀,37℃,1個大氣壓減壓蒸餾除乙醇,蒸餾濃縮到體積600毫升。
(2)粗濾:用截留分子量100000D的中空纖維柱粗濾,收集濾液;得到濾液500毫升。
(3)萃取:依次加入甲苯、
乙酸乙酯、正丁醇進行萃取,三種有機溶劑加入量均為500毫升,每次萃取充分混勻後靜置20分鐘等待混合液分層,然後用分液漏斗分離,每次都是除掉有機溶劑保留水溶液。
(4)層析:將萃取所得溶液在37℃,1個大氣壓減壓蒸餾濃縮至100毫升備用;用BIO-GEL-P2凝膠層析分離(按照凝膠說明書將膠處理好,灌柱平衡),層析柱長150厘米,直徑4.5厘米,膠床高度124厘米;將上述濃縮液100毫升加到膠床上,待其完全滲到膠面以下,連線流動相;以純化水作為流動相,流速40毫升/時;用自動餾分收集器收集層析液,20毫升/管,通過紫外分光光度計監測層析液吸光度,檢測波長為280納米;所得吸光度曲線如圖1所示。完全收集吸光度曲線上的第二吸收峰(F2)10管,收集液200毫升。圖1中,點號表示收集洗脫液的試管。
(5)病毒滅活:上述收集液在60℃水浴中保存10小時,即得小牛血清去蛋白提取液。
小牛血清去蛋白提取液再經過0.2微米孔徑的微孔濾膜過濾,無菌操作分裝至清洗乾淨的5毫升安瓿中,充氮封口,即得小牛血清去蛋白注射液。
取上述小牛血清去蛋白注射液作為供試品溶液上樣100微升,按照高效液相色譜法(《中國藥典》2005年版二部附錄VD),採用凝膠色譜柱(如TSK-G2000sw柱);流動相為pH7.0的0.1摩爾/升磷酸鹽進行高效液相色譜分析;用示差檢測器檢測,記錄色譜圖,記錄保留時間至第一主峰保留時間的2倍。以蔗糖色譜峰計算理論塔板數應不低於1000。按照面積歸一法計算,主峰面積應占93.0%以上。色譜圖如圖2所示,主峰面積占總面積的95%,說明所得產品中主糖相對於總糖的純度為95%。
b)小牛血清去蛋白注射液的生物活性指標的分析
選取10瓶小牛血清去蛋白注射液通過測定小分子肽含量、多糖含量和呼吸活性指標分析小牛血清去蛋白注射液生物活性指標。小分子肽含量測定採用lowry測蛋白法檢測;多糖含量測定採用苯酚一硫酸比色法檢測;呼吸活性檢測按照如下文獻方法進行,於洪儒、肖建英,促細胞代謝素注射液生物活性的實驗研究,《中國新藥雜誌》2000年第2期。
實驗結果表明,《一種小牛血清去蛋白注射液及其生產方法》的小牛血清去蛋白注射液小分子肽含量為1.17±0.02、多糖含量為0.043±0.006及呼吸活性為7.2±0.02。
c)小牛血清去蛋白注射液的穩定性
取《一種小牛血清去蛋白注射液及其生產方法》的小牛血清去蛋白注射液10支,置於人工氣候箱內,在溫度為50℃±2℃,相對濕度為75%±5%的環境中放置3個月,分別於第1個月、2個月、3個月取樣一次,檢測性狀、澄明度、呼吸活性指標,檢測結果與0月比較。性狀用肉眼觀察,呼吸活性檢測按照實施例2中所述文獻的方法,澄明度按照《中國藥典》2005版2部的方法檢測。
檢測結果表明在50℃±2℃,相對濕度為75%±5%的環境中放置3個月,該發明的小牛血清去蛋白注射液仍然很穩定性,呼吸活性為7.2±0.03(0月時,呼吸活性為7.2±0.02)。
d)病毒滅活有效性測定
《一種小牛血清去蛋白注射液及其生產方法》生產的小牛血清去蛋白注射液,在病毒滅活前向其中加入腦心肌炎病毒(EMCV)和牛腹瀉病毒(BVDV)為指示病毒,然後經過60℃水浴中保存10小時,通過病毒對照培養,結果顯示,《一種小牛血清去蛋白注射液及其生產方法》的病毒滅活方法可以使腦心肌炎病毒滴度下降≥5.00LgTCID50/0.1毫升;可以使牛腹瀉病毒滴度下降≥4.00LgTCID50/0.1毫升。因此,《一種小牛血清去蛋白注射液及其生產方法》的病毒滅活工藝能夠有效滅活非脂包膜病毒和脂包膜病毒,能保證產品的安 全性。
a)生產小牛血清去蛋白注射液
(1)除蛋白:取小牛血清1000毫升(購於內蒙科左中旗錦康牛製品開發有限公司),加入2000毫升96%的乙醇,混勻後,靜置30分鐘;離心(4000轉/分,10分鐘)後留上清,棄沉澱;利用真空旋轉蒸發儀,37℃,1個大氣壓減壓蒸餾除乙醇,蒸餾濃縮到體積600毫升。
(2)粗濾:用截留分子量100000D的中空纖維柱粗濾,收集濾液;得到濾液500毫升。
(3)層析:將粗濾所得濾液在37℃,1個大氣壓減壓蒸餾濃縮至100毫升備用;用BIO-GEL-P2凝膠層析分離(按照凝膠說明書將膠處理好,灌柱平衡),層析柱長150厘米,直徑4.5厘米,膠床高度124厘米;將上述濃縮液100毫升加到膠床上,待其完全滲到膠面以下,連線流動相;以純化水作為流動相,流速40毫升/時;用自動餾分收集器收集層析液,20毫升/管,通過紫外分光光度計監測層析液吸光度,檢測波長為280納米;完全收集吸光度曲線上的第二吸收峰(F2)10管,收集液200毫升。
(4)病毒滅活:上述收集液在60℃水浴中保存10小時,即得小牛血清去蛋白提取液。
小牛血清去蛋白提取液再經過0.2微米孔徑的微孔濾膜過濾,無菌操作分裝至清洗乾淨的5毫升安瓿中,充氮封口,即得小牛血清去蛋白注射液。
選擇小白鼠常壓耐缺氧能力影響實驗檢驗《一種小牛血清去蛋白注射液及其生產方法》產品的療效。
一、實驗材料
1、實驗藥品:實施例1生產的小牛血清去蛋白注射液和對比例生產的小牛血清去蛋白注射液。
2、動物:昆明種一級小白鼠(購於遼寧醫學院實驗動物中心),體重18~22克,雌雄各半。
3、鹼石灰及250毫升廣口瓶。
二、實驗方法
1、動物分組:選擇健康的昆明種一級小白鼠60隻,體重18~22克,雌雄各半,分成三組,即實驗組、陽性對照組、空白對照組,每組20隻。
2、實驗方法:I、II、III三組分別為實驗組、陽性對照組、空白對照組,每隻小鼠一天給藥一次,給藥方式為尾靜脈注射,每次0.1毫升。實驗組用實施例1生產的小牛血清去蛋白注射液給藥;陽性對照組用對比例生產的注射液給藥;空白對照組以注射用水配製的生理鹽水給藥。
3、各組小白鼠連續給藥11天,於末次給藥後30分鐘將所有小白鼠放入裝有10克鹼石灰的250毫升廣口瓶中,密閉常壓缺氧,觀察小白鼠存活時間,小白鼠死亡後測定腦組織中葡萄糖和乳酸的含量;腦乳酸和葡萄糖含量測定按照如下文獻所述方法進行:毛捷、陳勁草,GM1對大鼠腦缺血再灌注損傷的乳酸及葡萄糖含量的影響,《安徽醫科大學學報》2004年39卷6期。
三、實驗結果
常壓缺氧小白鼠存活時間測定結果見表1;常壓缺氧小白鼠腦乳酸含量測定結果見表2;常壓缺氧小白鼠腦葡萄糖含量測定結果見表3。表1、2和3中的數據為平均值±標準差。
表1.常壓缺氧小白鼠存活時間

表1
表1中*表示同III組比較P<0.01;△表示同II組比較P<0.01。
表1表明,實驗組和陽性對照組小白鼠存活時間均明顯長於空白對照組;而實驗組小白鼠存活時間又明顯長於陽性對照組。
表2.常壓缺氧小白鼠腦乳酸含量
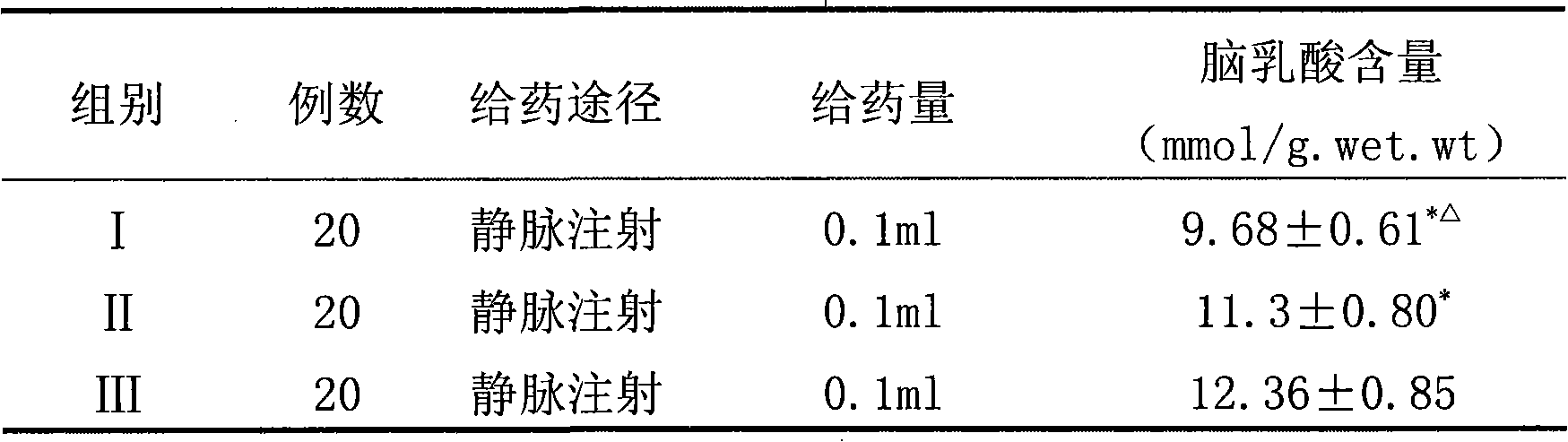
表2
表2中*表示同III組比較P<0.01;△表示同II組比較P<0.01。
表2表明,實驗組和陽性對照組小白鼠腦乳酸含量明顯低於空白對照組;而實驗組小白鼠腦乳酸含量明顯低於陽性對照組。
表3.常壓缺氧小白鼠腦葡萄糖含量
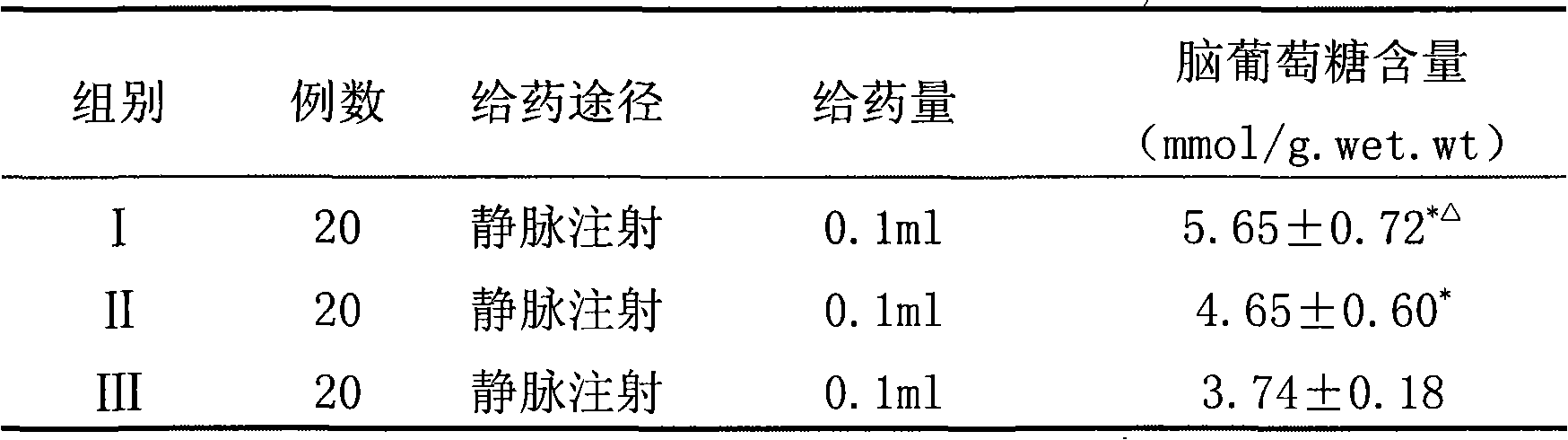
表3
表3中*表示同III組比較P<0.01;△表示同II組比較P<0.01。
表3表明,實驗組和陽性對照組小白鼠腦葡萄糖含量明顯高於空白對照組,實驗組小白鼠腦葡萄糖含量又明顯高於陽性對照組。
實驗結果表明,實施例1生產的小牛血清去蛋白注射液能夠明顯延長常壓缺氧小白鼠的存活時間,而且能夠提高常壓缺氧小白鼠腦葡萄糖含量並能降低腦乳酸含量,說明實施例1生產的小牛血清去蛋白注射液能夠促進葡萄糖的吸收和代謝,對抗腦缺氧,抑制無氧代謝。因此實施例1生產的小牛血清去蛋白注射液對腦缺血缺氧性疾病具有確切的治療作用,並且實施例1生產的小牛血清去蛋白注射液的穩定性優於用其他方法獲得的小牛血清類產品。
榮譽表彰
2018年12月20日,《一種小牛血清去蛋白注射液及其生產方法》獲得第二十屆中國專利獎優秀獎。






