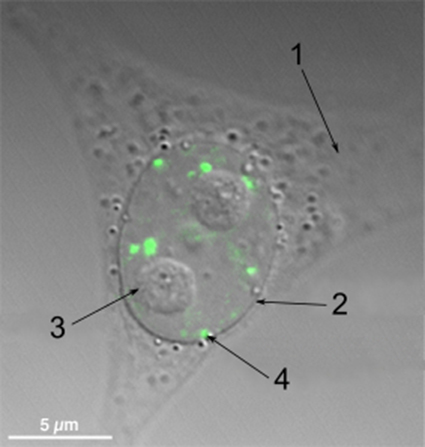
細胞生物學中,paraspeckle小體指細胞核染色質間隙中的一種不規則亞結構區域,大小約0.2-1微米。這種結構首先在Hela細胞中被發現,大約在每個細胞核中存在10-30個。後續研究表明,這種結構存在於所有的人類原代細胞,轉化細胞以及組織切片中。這種結構的功能尚不清楚,但可能在細胞核中的蛋白質定位過程中起作用。
基本介紹
- 外文名:paraspeckle
- 分類:細胞核亞結構
- 所屬領域:細胞生物學
動態結構,功能,
動態結構
paraspeckle是一種動態結構,會隨細胞代謝活動的變化而改變。這種結構依賴於轉錄。所有五種已在此結構中發現的蛋白(PSP1,p54nrb,PSP2,CFI(m)68,PSF)都具有RNA識別結構單元。當RNA聚合酶II不轉錄時,paraspeckle結構消失,所有其包含物質在核仁中形成新月形的核周帽(perinucleolar cap)。這種現象在細胞周期中得到了證明。paraspeckle在分裂間期以及除末期以外的分裂期記憶體在,而分裂末期時,兩個子細胞核形成時RNA聚合酶II轉錄不發生,因此paraspeckle消失而形成核周帽結構。使用轉錄抑制性藥物的實驗同樣證明了這點。
功能
paraspeckle的功能目前還沒有被很好地解釋。據推測,其蛋白質組分p54nrb的活性依賴於其定位,因此該結構可能通過提供其組分蛋白的有序定位來指導它們的活動。也有假設稱paraspeckle與轉錄調控有關。對於此結構的更深層次了解仍需要從其各蛋白組分的功能入手。
對於PSP1蛋白定位模式的研究導致了paraspeckle的發現。而對於該蛋白,有研究者推測高度集中於睪丸中的該蛋白可能參與調節生殖細胞的早期mRNA加工,並有助於精子發生過程中的染色質重塑與核形成。PSP1還與p54nrb形成二聚體。p54nrb參與包括轉錄調控,剪接,DNA解旋,病毒RNA加工,細胞增殖控制以及晝夜節律維持等多種核功能。而另一種蛋白組分——PSP2參與RNA剪接以及激素受體的共激活。
後續發現paraspeckle中還可能存在兩種蛋白質組分——CFI(m)68和PSF。CFI(m)68被認為與前體mRNA3‘端的剪下有關。而PSF可以與RNA或DNA結合,並與前體mRNA剪下蛋白相互作用。另外,該蛋白與PSP1具有相同的定位,轉錄被抑制時,也在核周帽中有相同的定位。如果PSF是paraspeckle的一部分,那么可以進一步證明paraspeckle參與前體mRNA剪接的論斷。
在2005年的研究中,一種新的控制基因表達方式中paraspeckle的作用被提出。在該研究中,一種核富集的非編碼RNA(CTNRNA)被發現特異性定位於幾種細胞核內的paraspeckle中。研究人員發現,這種RNA在核內paraspeckle中儲存,並通過直接的蛋白-RNA相互作用與p54nrb和PSP1結合。CTNRNA是編碼膜蛋白MCAT2(陽離子胺基酸轉運蛋白)基因的另一種較長轉錄物。當細胞受到應激時,CTNRNA信號強度下降而MCAT2-mRNA以及MCAT2蛋白質信號增強。因此paraspeckle可能是剪接和加工的CTNRNA的儲存位點,當細胞收到信號時,RNA被釋放並轉運至細胞質翻譯合成相應的蛋白。這種“快速釋放核保留機制”被認為可以在核內保持25分鐘。