c-met與大腸癌指c-met蛋白產物和大腸癌的關係。
基本介紹
- 中文名:c-met與大腸癌
- 病因:消化道常見惡性腫瘤
- 發病過程:原癌基因的激活和抑癌基因的失活
- 腫瘤轉移原因:c-met過度表達和基因擴增
大腸癌是消化道常見惡性腫瘤,其發病過程中存在許多原癌基因的激活和抑癌基因的失活。c-met是一種由c-met原癌基因編碼的蛋白產物,為肝細胞生長因子受體,具有酪氨酸激酶活性,與多種癌基因產物和調節蛋白相關,參與細胞信息傳導、細胞骨架重排的調控,是細胞增殖、分化和運動的重要因素。c-met與多種癌的發生和轉移密切相關,研究表明,許多腫瘤病人在其腫瘤的發生和轉移過程中均有c-met過度表達和基因擴增。本文就c-met在大腸腫瘤中的作用作一綜述。
1 c-met基因的結構和功能
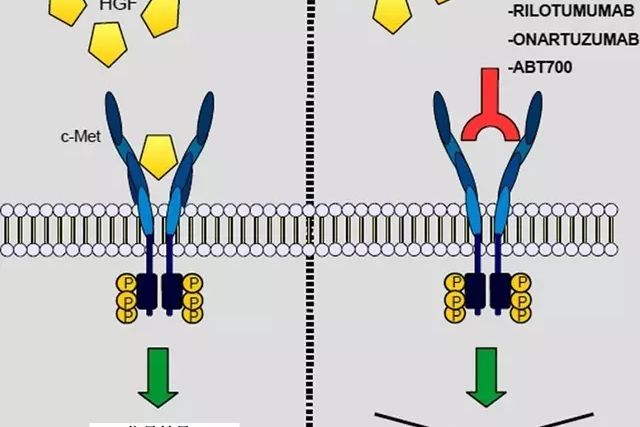
1984年Cooper在研究人骨肉瘤Hos細胞系時,克隆出了一個具有轉化活性的片段,定名為c-met [1] 。c-met位於人類7號染色體長臂(7q31)。c-met基因大小約110kb,包括21個外顯子。啟動子區域有許多調控序列,如IL-6和HGF等 [2]。在不同組織和細胞系中c-met的轉錄產物有多種。如9.0、7.0、6.0、5和3.5的mRNA,這可能是由於轉錄的啟始位點及剪下的方式不同造成的。各種轉錄產物的功能尚不清楚,但某些轉錄產物只在特定的癌組織中出現,因此,這些轉錄產物可能與特定組織的癌變有關。9.0kb轉錄產物較普遍存在,是編碼正常膜受體的轉錄產物。其前體蛋白分子量為140KD,經糖基化作用產生170KD的糖蛋白。進而切割成50KD的α亞基和145kD的β亞基,兩個亞基以二硫鍵相連形成190kD的成熟受體蛋白。成熟的受體蛋白位於細胞膜上。β亞基有胞外區、跨膜區和胞內區。α亞基只有胞外部分,藉助於二硫鍵附於β亞基上。α亞基和β亞基的胞外區是配體識別部位,而胞內部分具有酪氨酸激酶活性。c-met受體的配體是肝細胞生長因子(hepatocyte growth factor,HGF),也稱為離散因子(scatter facˉtor)。由於c-met在不同細胞、不同分化階段作用的底物不同,使其在特定的條件下表現出多種功能:(1)促進肝細胞、內皮細胞和黑色素細胞的分裂;(2)引起上皮細胞的分散,在胚胎髮育過程中控制細胞的移動;(3)誘導細胞形態變化[3] 。2 c-met的激活及其與癌變的關係
2.1 依賴HGF的激活機制 在腫瘤細胞中有許多分子機制可以激活c-met,最常見的方式是通過HGF和c-met結合發揮作用。HGF和c-met結合導致受體自身磷酸化,增強了c-met酪氨酸激酶的活性,導致多種底物蛋白的酪氨酸磷酸化。如磷脂酸Cr、P13-K、生長因子受體結合蛋白-1、生長因子受體結合蛋白-2和信號轉導與轉錄因子-3等 [4] 。在生理情況下,c-met受體和HGF短暫結合發揮生理效應。在腫瘤組織同時高表達HGF和c-met,形成正反饋,導致腫瘤的無限生長和侵襲行為。這種正反饋已經在神經膠質瘤、骨肉瘤、 乳腺癌 等惡性腫瘤中得到證實 [5,6] 。HGF和c-met同時高表達的腫瘤惡性程度高,預後不良。在生理情況下HGF並非是自分泌的,而是以旁分泌的方式發揮生理效應,間充質細胞產生HGF,HGF再結合於表達c-met的上皮細胞或其他細胞,激活c-met發揮效應。同樣的,表達c-met的腫瘤細胞可以基質細胞分泌HGF發揮作用。然而,HGF是以單鏈的形式由細胞分泌的酶原形式,它必須經過酶的作用成為活性的HGF,許多絲氨酸酶如尿激酶型纖溶酶原激活物,凝血因子XII等都可活化HGF,在有些腫瘤中已經得到證實 [6]。
2.2 不依賴HGF配體的機制 c-met可以不依賴HGF而被激活,特別是在met過度表達的腫瘤。met蛋白的高表達可能是由於c-met基因的擴增、轉錄增強或轉錄後機制。Cooper首次克隆出的met基因就是重排後的激活形式,它是1號染色體的啟動子和TPR基因序列的N末端與7號染色體met序列的C末端形成的嵌合基因tpr-met,這個嵌合基因編碼的細胞質蛋白包括tpr編碼的亮氨酸拉鏈區和met編碼的酪氨酸激酶區,由於亮氨酸拉鏈區的存在,導致met激酶持續激活,促使細胞向惡性轉化 [7]。在 結腸癌LOVO細胞系,由於轉錄的不正常,met以單體的形式存在於細胞表面而具有持續的酪氨酸激酶活性。在轉移性黑色素瘤B16細胞系,由於細胞內磷酸化酶的減少,met蛋白不能去磷酸化而有持續活性。met基因的點突變也可以導致met激酶持續激活,已經發現了21個點突變可以導致met激活 [8] 。
2.3 其他膜受體途徑 最近的研究表明 [9] ,met激酶可以通過其它膜受體如CD44、粘附素和RON信號傳導途徑等而被激活。CD44是透明質酸膜表面受體,調節許多正常細胞活動,在腫瘤的浸潤和轉移中也起著重要作用。CD44通過兩個機制激活met蛋白:(1)CD44與透明質酸結合使c-met激活;(2)CD44與HGF結合,然後再與met結合,激活met蛋白,這種效應遠大於單純的HGF效應。
3 c-met在大腸癌癌前病變的研究
Kitamura等 [10] 發現在潰瘍性結 腸炎 的炎症黏膜中c-met表達增高,潰瘍性結腸炎癌變黏膜c-met高表達,提示c-met的不正常表達容易導致潰瘍性結腸炎癌變。Liu [11] 等發現在結腸腺瘤中c-met mRNA也增高,提示c-met原癌基因在結腸癌的發病早期可能起作用。
4 c-met在大腸癌中的表達
Liu等 [11] 研究正常結腸黏膜和結腸癌中c-met mRNA的表達,正常結腸黏膜中c-met mRNA明顯低於結腸癌黏膜,結腸癌中c-met mRNA較正常結腸黏膜中高6倍。Fuˉjita等 [12] 用反轉錄PCR的方法研究27例大腸癌和10例大腸癌肝轉移標本中c-met mRNA的表達,發現大腸癌中c-met mRNA的表達明顯高於正常黏膜(P癌症 的發生是一個複雜的過程,存在許多分子機制。由於c-met在惡性腫瘤中的重要作用,因此,通過某些分子途徑來抑制c-met的過度表達,有可能抑制惡性腫瘤的增殖和轉移。Wielenga [9] 等研究表明大腸癌組織較正常大腸HGF明顯增高,提示HGF依賴的met激活機制在大腸癌的發生中起著重要作用。針對HGF/c-met途徑的惡性腫瘤防治研究仍處於基礎研究階段。1997年,Date等通過對重組HGF進行裂解發現了一種新的HGF拮抗劑,命名為NK4,NK4可以與c-met結合,競爭性完全抑制HGF/c-met系統的信號轉導,從而抑制HGF所誘導的細胞增殖、運動和形態形成等,體外研究 [16] 證實NK4可抑制HGF誘導的結腸癌細胞的運動和侵襲。c-met受體在正常的細胞發育和分化中也起著重要作用,如何抑制c-met的負面效應而不影響c-met的正常功能尚有待進一步研究。莊小強等 [17] 報導,c-met原癌基因的高表達病人預後不良,c-met原癌基因的突變可作為判斷 胃癌 預後一個新的重要指標。在大腸癌c-met與預後的研究比較少,Wielenga等 [9] 報導,c-met和CD44同時高表達的病人預後不良。c-met能否成為大腸癌預後的新指標尚有待進一步研究。
6 結語
大腸癌發生機制相對於其他惡性腫瘤來說較為清楚,但仍有許多問題尚未解決,特別是早期發生階段的機制還不清楚。眾多研究提示c-met在大腸癌發病早期起著重要作用,因此研究c-met蛋白對大腸癌有著重要意義。對met蛋白在癌症中的作用研究已經取得了很大進展,但仍有一些問題。首先,met蛋白在各種癌症中失調機制需要進一步臨床和基礎研究,met蛋白的失調可能是met基因的突變、重排或擴增,也可能是其他分子機制導致的met蛋白失調,研究met信號途徑在正常細胞中調控和在腫瘤中的失調機制,可能為治療癌症提供新的思路。另外,met 蛋白的三維空間結構需要進一步研究。最後,met蛋白與其他癌基因在癌症中的相互關係仍待進一步明確。