酮和胺在過量的甲酸作為還原劑的條件下進行還原胺化的反應。當用醛作為底物的反應為Eschweiler–Clarke還原胺化反應。
基本介紹
- 中文名:Leuckart-Wallach反應
- 底物:酮和胺
- 還原劑:過量的甲酸
- 過程:還原胺化
- 領域:有機合成
簡介,反應原理,反應舉例,影響因素,
簡介
Leuckart-Wallach反應是將醛或酮羰基化合物分別與胺、伯胺或仲胺以甲酸(或甲酸銨、甲醯胺)作為還原劑一起加熱,分別製得伯胺、仲胺和叔胺的反應。該方法適用於多數脂肪酮、脂環酮、脂環-芳香酮、雜環酮等,對芳香醛及高沸點的芳香酮更為適用。
反應原理
胺先親核進攻酮生成胺基醇,脫水得到亞胺離子中間體,甲酸還原得到產物。
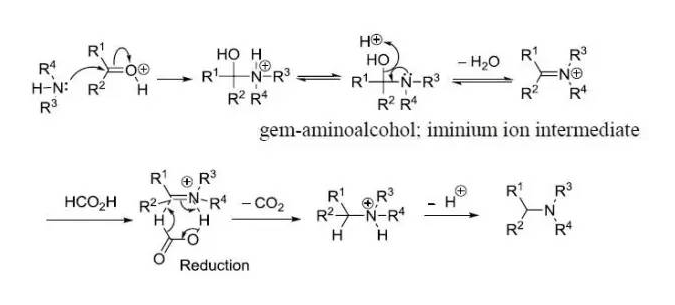 反應原理
反應原理反應舉例
1-[二-(4-氟苯基)甲基]哌嗪(1)是一種非常重要的藥物中間體,隨哌嗪環4-位引入取代基的不同,可產生不同的生物活性,如鈣拮抗劑(鹽酸洛美利嗪)、抗氧化劑(AD0261)以及癌症治療中多種抗藥性的調節劑(almitrine)等。在合成1-[二-(4-氟苯基)甲基]哌嗪4-取代衍生物過程中,通過Leuckart-Wallach反應合成了以下化合物,反應路線如下。
 路線圖
路線圖影響因素
1、原料對Leuckart-Wallach反應的影響
Leuckart-Wallach反應能否發生與原料活性有一定關係。 1-[二-(4-氟苯基)甲基]哌嗪可看作仲胺,與活性較大的取代苯甲醛反應生成叔胺。環己酮的活性較芳香酮及雜環酮強,環己酮能發生Leuckart-Wallach反應得到叔胺,而苯乙酮及2-呋喃乙酮卻難發生Leuckart-Wallach反應。
2、甲醯化產物產生的原因
該化合物產生的原因可能是由於苯乙酮及2-呋喃乙酮活性差, Leuckart-Wallach反應發生受阻。在此條件下,發生的是另一類型的反應即與甲酸的脫水反應,得到的是化合物1的甲醯化產物。
3、Leuckart-Wallach反應與甲醯化反應的競爭
在Leuckart-Wallach反應中,同時還可能伴隨甲醯化反應。由於醛的活性大,Leuckart-Wallach反應占主導,產物為胺。芳香酮或雜環酮活性小,不易發生Leuckart-Wallach反應,發生的是甲醯化反應。我們推測甲醯化反應有可能是Leuckart-Wallach反應中普遍存在的副反應。

